Karakteristične osobine tvari (fizikalna i kemijska)
karakteristična svojstva tvari to su kemijska ili fizikalna svojstva koja mogu pomoći identificirati ili razlikovati jednu tvar od druge. Fizička svojstva su karakteristike tvari koje se promatraju osjetilima. Kemijska svojstva su karakteristike koje opisuju kako se tvar mijenja iz jedne tvari u drugu tijekom kemijske reakcije.
Neka fizikalna svojstva tvari su gustoća, topljivost, točka taljenja, boja i masa. Kemijska svojstva materijala uključuju zapaljivost, reaktivnost s kiselinama i koroziju. Neki primjeri kako svojstva materije mogu pomoći identificirati element je usporedba gustoće različitih elemenata.
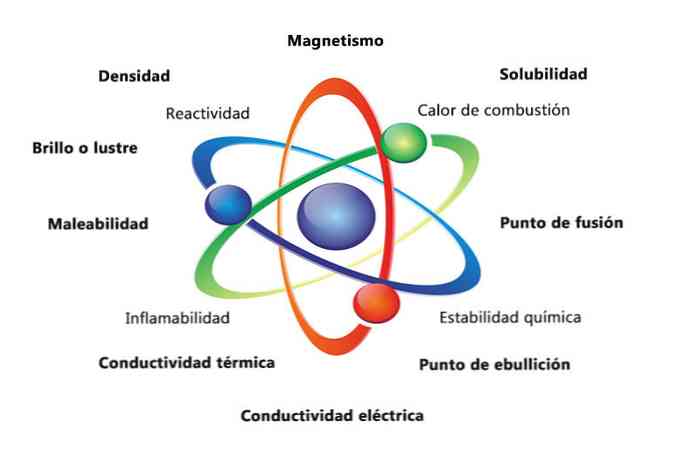
Element kao što je zlato ima gustoću od 19,3 grama po kubičnom centimetru, dok je gustoća sumpora 1,96 grama po kubičnom centimetru. Slično, točke taljenja tvari kao što su voda i izopropilni alkohol su različite.
Fizikalna svojstva tvari
Fizička svojstva materije su svojstva koja se mogu mjeriti ili promatrati bez promjene kemijske prirode tvari. Neki primjeri fizičkih svojstava su:
- Gustoća: količina tvari koja ima predmet izračunava se dijeljenjem mase po volumenu.
- Magnetizam: sila privlačenja između magneta i magnetskog objekta.
- Topljivost: mjera koliko se tvar može otopiti u drugoj tvari.
- Točka taljenja: temperatura na kojoj se tvar mijenja od krute do tekuće.
- Vrelište: temperatura na kojoj se tvar mijenja iz tekućeg u plin.
- Električna provodljivost: mjera je koliko se struje kreću kroz tvar.
- Toplinska provodljivost: brzina kojom tvar prenosi toplinu.
- Gipkost: je sposobnost tvari da se valja ili melje na različite načine.
- Sjaj ili sjaj: koliko lako objekt reflektira svjetlost.
Kemijska svojstva tvari
Kemijska svojstva opisuju sposobnost tvari da se transformira u novu tvar s različitim svojstvima. U nastavku slijedi nekoliko primjera kemijskih svojstava:
- Toplina sagorijevanja: je energija koja se oslobađa kada spoj prođe kroz potpuno izgaranje s kisikom.
- Kemijska stabilnost: odnosi se na to da li će spoj reagirati s vodom ili zrakom (kemijski stabilne tvari neće reagirati).
- Zapaljivost: sposobnost spoja da izgori pri izlaganju plamenu.
- Reaktivnost: sposobnost interakcije s drugom tvari i formiranjem jedne ili više novih tvari.
Fizikalna stanja materije
Materija je sve što zauzima prostor, koji ima masu i koja se može opažati našim osjetilima. Materija se može klasificirati prema svom fizičkom stanju: krutom, tekućem i plinovitom.
1 - Čvrste tvari i njihova karakteristična svojstva
Sve krutine imaju masu, zauzimaju prostor, imaju definiran volumen i oblik, ne klize kroz prostor i ne mogu se stisnuti ili imati kruti oblik. Kao primjer imamo: drvo, knjige, spužve, metal, kamenje itd..
U krutim tvarima, male čestice materije su vrlo blizu i dodiruju jedna drugu. Čestice su toliko blizu da se ne mogu puno pomaknuti, između njih je vrlo malo prostora.
2 - Tekućine i njihova karakteristična svojstva
Sve tekućine imaju masu, zauzimaju prostor, ali ne i imati određen volumen određen oblik (kao što su prilagoditi kontejner gdje su), može se sažeti u vrlo maloj mjeri i može kliziti kroz prostor. Kao primjer imamo: vodu, kerozin, ulje, itd..
U tekućinama, male čestice materije su malo dalje jedna od druge, postoji više prostora između njih (u usporedbi s krutim tvarima) i one se ne dodiruju. Stoga se čestice mogu kretati između prostora, gurajući se i sudarajući s drugim česticama, stalno mijenjajući smjer.
3- Plinovi i njihova karakteristična svojstva
Svi plinovi imaju masu, zauzimaju prostor, nemaju definirani volumen ili oblik, mogu se u velikoj mjeri stisnuti i mogu difundirati u prostor. Kao primjeri imamo: vodik, kisik, dušik, ugljični dioksid, para, itd..
U plinovima, male čestice materije su mnogo udaljenije, između njih je mnogo više prostora (u usporedbi s tekućinama) i ne dodiruju se. Čestice imaju maksimalnu slobodu kretanja pa se guraju i sudaraju s drugim česticama koje stalno mijenjaju smjer.
Promjene stanja tvari
Materija se može pretvoriti iz čvrstog stanja u tekuće stanje i obratno, te iz tekućeg stanja u plinovito stanje i obrnuto. Ova konverzija uzima naziv promjene stanja i događa se promjenom temperature:
integracija
Promjena stanja materijala iz krutog u tekuće pomoću povećanja temperature. Kada se čvrsta tvar zagrije, toplina uzrokuje da čestice vibriraju snažnije.
Kada su došli do točke taljenja krutih čestica dovoljno kinetičku energiju za prevladavanje jake privlačne sile koje ih drže u fiksnim položajima, a razbijena u male skupine tekućih čestica.
Vrelište ili isparavanje
Promjena stanja tekuće tvari u plinovito pomoću povećanja temperature. Kada se tekuća tvar zagrije, toplina čini čestice još bržim.
Kada dostignu točku ključanja, tekuće čestice imaju dovoljno kinetičke energije da prevladaju sile privlačenja koje ih drže u fiksnim položajima i razdvajaju se u pojedinačne plinovite čestice..
Zamrzavanje ili skrućivanje
Promjena stanja tekuće tvari u krutu pomoću pada temperature. Kada se tekuća tvar ohladi, njezine čestice gube mnogo kinetičke energije. Kada dostignu točku smrzavanja, čestice se zaustavljaju i vibriraju u fiksiranom položaju, pretvarajući se u čvrste čestice.
Ukapljivanje ili kondenzacija
Promjena stanja plinovite tvari u tekućinu pomoću smanjenja temperature. Kada se plinovita tvar ohladi, njezine čestice gube veliku kinetičku energiju, što uzrokuje njihovo međusobno privlačenje da postanu tekuće čestice.
sublimacija
Neki materijali se izravno mijenjaju iz čvrstog stanja u svoje plinovito stanje ili obratno, bez prolaska kroz tekuće stanje. Kada se te krute tvari zagrijavaju, njihove se čestice kreću tako brzo da odvajaju potpuno formirajući paru ili plin, i obratno kada se proces odvija od plinovite do čvrste tvari.
reference
- De Podesta, M. Razumijevanje svojstava materije, drugo izdanje. Velika Britanija: Taylor i Francis.
- A. Stanja materije. New Delhi: Izdavačka kuća Discovery.
- Moore J, Stanitski C. Molekularna znanost, 5. izdanje. Stamford: Učenje Cengagea.
- Ramakrishna A. Priroda materije, 1. izdanje. New Delhi: Braća Goyal Prakashan.
- Reger D, Goode S, Ball D. Kemija. Načela i praksa, 3. izdanje. Kanada: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (fizika). Preuzeto s: accessscience.com.
- Singh L, Kaur M. Materija u našoj okolici. Indija: Škola S. Chand.


