Kemijska aktivacijska energija iz čega se sastoji, kalkulacija
kemijska aktivacijska energija (sa stajališta kinetičkih studija) odnosi se na najmanju moguću količinu energije potrebne za početak kemijske reakcije. Prema teoriji kolizija u kemijskoj kinetici, rečeno je da sve molekule koje su u pokretu imaju određenu količinu kinetičke energije..
To znači da što je veća brzina vašeg kretanja, to je veća veličina vaše kinetičke energije. U tom smislu, molekula koja nosi brzo kretanje ne može se sama podijeliti na fragmente, tako da mora doći do sudara između njega i druge molekule tako da može doći do kemijske reakcije..
Kada se to dogodi - kada dođe do sudara između molekula - dio njegove kinetičke energije pretvara se u vibracijsku energiju. Isto tako, ako je na početku procesa kinetička energija visoka, molekule koje sudjeluju u sudaru predstavljat će tako veliku vibraciju da će neke od prisutnih kemijskih veza biti slomljene..
Ovo lomljenje veza je prvi korak u transformaciji reaktanata u proizvode; to jest, u njihovom oblikovanju. S druge strane, ako je na početku ovog procesa kinetička energija male veličine, pojavit će se fenomen "odbijanja" molekula, kroz koje će se praktički odvojiti netaknute..
indeks
- 1 Od čega se sastoji??
- 1.1 Aktivirani kompleks
- 2 Kako se izračunava?
- 2.1 Izračun energije aktivacije kemijske reakcije
- 3 Kako energija aktivacije utječe na brzinu reakcije?
- 4 Primjeri izračuna aktivacijske energije
- 5 Reference
Od čega se sastoji??
Polazeći od koncepta sudara između molekula za pokretanje prethodno opisanih kemijskih reakcija, može se reći da postoji minimalna količina energije potrebna za pojavljivanje sudara..
Dakle, ako je energetska vrijednost manja od minimalno potrebnog, jednostavno će biti bez promjena između molekula nakon podnošenja sudara, što znači da kada ta energija je odsutan, vrsta uključenih u velikoj mjeri ostaju netaknuti i neće dogoditi svaka promjena zbog tog šoka.
U tom redoslijedu ideja, minimalna energija potrebna za promjenu nakon sudara molekula naziva se energija aktivacije.
Drugim riječima, molekule uključene u šok moraju imati količinu ukupne kinetičke energije s veličinom jednakom ili većom od energije aktivacije tako da može doći do kemijske reakcije.
Također, u mnogim slučajevima molekule se sudaraju i potječu od nove vrste nazvane aktivirani kompleks, struktura koja se također naziva "tranzicijsko stanje" jer samo privremeno postoji..
Ona je uzrokovana vrstama reaktanata zbog sudara i prije stvaranja produkata reakcije.
Aktivirani kompleks
Gore spomenuti aktivirani kompleks formira vrstu koja ima vrlo nisku stabilnost, ali koja zauzvrat ima veliku količinu potencijalne energije.
Sljedeći dijagram prikazuje transformaciju reaktanata u produkte, izražene u energetskom smislu, uz napomenu da je energija aktiviranog kompleksa koji se formira znatno veća od reaktanata i produkata..
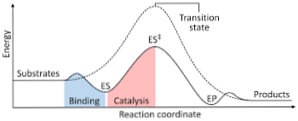
Ako na kraju reakcije proizvodi imaju veću stabilnost od tvari reaktanata, oslobađanje energije se odvija u obliku topline, što daje egzotermičku reakciju..
Naprotiv, ako reaktanti rezultiraju stabilnošću veće veličine od proizvoda, to znači da reakcijska smjesa pokazuje apsorpciju energije u obliku topline iz okoline, što rezultira endotermičkom reakcijom..
Isto tako, ako se dogodi jedan slučaj ili drugi, mora se konstruirati dijagram, kao što je onaj koji je prethodno prikazan, gdje se crta potencijalna energija sustava koji reagira protiv napretka ili napretka reakcije..
Na taj se način dobivaju potencijalne promjene energije koje se događaju tijekom reakcije i reaktanti se pretvaraju u proizvode.
Kako se izračunava?
Aktivacijska energija kemijske reakcije blisko je povezana s konstantom brzine te reakcije, a ovisnost te konstante o temperaturi predstavlja Arrheniusova jednadžba:
k = Ae-Ea / RT
U ovom izrazu k predstavlja konstantu brzine reakcije (koja ovisi o temperaturi) i parametar to se naziva frekvencijski faktor, a to je mjera učestalosti sudara među molekulama.
Sa svoje strane, i izražava osnovu niza prirodnih logaritama. Povećava se na snagu jednaku negativnom količniku energije aktivacije (ea) između proizvoda koji nastaje plinskom konstantom (R) i apsolutnu temperaturu (T) sustava koji treba razmotriti.
Treba napomenuti da se frekvencijski faktor može smatrati konstantom u određenim reakcijskim sustavima u širokom temperaturnom rasponu.
Ovaj matematički izraz je navodno u početku nizozemsko-rođen kemičar Jacobus Henricus van't Hoff 1884, ali tko je dao znanstvenu valjanost i tumači njegova pretpostavka bila je švedski kemičar Svante Arrhenius podrijetlo, 1889.
Izračun energije aktivacije kemijske reakcije
Arrheniusova jednadžba ukazuje na izravnu proporcionalnost koja postoji između konstante brzine reakcije i učestalosti sukoba između molekula..
Također, ova se jednadžba može predstaviti na prikladniji način primjenom svojstva prirodnih logaritama na svaku stranu jednadžbe, dobivši:
ln k = ln A - Ea / RT
Kod promjene reda kako bi se dobila jednadžba pravca (y = mx + b), postignut je sljedeći izraz:
ln k = (- Ea / R) (1 / T) + ln A
Na taj način, kod gradnje dijagram ln k od 1 / T ravnu liniju, pri čemu je dobiven ln k predstavlja y koordinata, (-Ea / R) predstavlja nagib linije (m), (1 / T) predstavlja x koordinata, a ln a predstavlja križanje s y-osi (b).
Kao što se može vidjeti, nagib koji je rezultat ovog izračuna jednak je vrijednosti -Ea / R. To znači da, ako se želi postići vrijednost aktivacijske energije pomoću ovog izraza, treba provesti jednostavno čišćenje, što rezultira:
Ea = -mR
Ovdje znamo da je vrijednost m i R konstanta jednaka 8,314 J / K · mol.
Kako energija aktivacije utječe na brzinu reakcije?
Kada pokušavamo napraviti sliku aktivacijske energije, ona se može smatrati preprekom koja ne dopušta pojavu reakcije između molekula niže energije..
Kao što se u zajedničkoj reakciji događa da je broj molekula koje mogu reagirati prilično velik, brzina - i ekvivalentno, kinetička energija tih molekula - može biti vrlo promjenjiva..
Obično se dogodi da samo mala količina ukupnosti molekula koje doživljavaju sudar - one koje imaju veću brzinu kretanja - predstavljaju dovoljno kinetičke energije da bi mogle prevladati veličinu aktivacijske energije. Dakle, te molekule su prikladne i sposobne biti dio reakcije.
Prema Arrheniusovoj jednadžbe, negativan znak koji prethodi odnos između energije aktivacije i proizvoda konstante plina pomoću apsolutne temperature znači da je brzina konstantna smanjuju predstavlja imaju povećanje aktivacije energije, i povećava temperatura rasta.
Primjeri izračuna aktivacijske energije
Da se izračuna energija aktiviranja izgradnjom graf prema Arrheniusovoj jednadžbi, mora biti konstanta brzine razgradnje za reakciju acetaldehida izmjerene su u pet različitih temperatura i poželjno je da se odredi aktivacijsku energiju za reakciju, koja se izražava kao:
CH3CHO (g) → CH4(g) + CO (g)
Podaci za pet mjerenja su sljedeći:
k (l / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700-730-760-790-810
Prvo, kako riješiti ovaj misterij i odrediti aktivacijska energija je izgraditi parceli od ln k vs 1 / T (y vs x) kako bi se dobio pravac i odavde uzeti nagib i pronaći vrijednost Ea, kao što je objašnjeno.
Pretvarajući podatke mjerenja, prema Arrheniusovoj jednadžbi [ln k = (- Ea / R) (1 / T) + ln A] nalaze se sljedeće vrijednosti za y i x, redom:
u k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1.37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Od tih vrijednosti i pomoću matematičkog izračuna nagiba - ili u računalu ili u kalkulatoru, pomoću izraza m = (Y)2-i1) / (X2-X1) ili metodom linearne regresije - dobijamo da je m = -Ea / R = -2.09 * 104 K. Dakle:
Ea = (8.314 J / K · mol) (2.09x104 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
Da bi se odredile druge energije aktivacije grafičkim putem, provodi se sličan postupak.
reference
- Wikipedia. (N. D.). Aktivacijska energija. Preuzeto s en.wikipedia.org
- Chang, R. (2007). Kemija, 9. izdanje. Meksiko: McGraw-Hill.
- Britannica, E. (s.f.). Aktivacijska energija. Preuzeto s britannica.com
- Moore, J.W. i Pearson, R.G. (1961). Kinetika i mehanizam. Preuzeto s books.google.co.ve
- Kaesche, H. (2003). Korozija metala: fizičko-kemijski principi i aktualni problemi. Preuzeto s books.google.co.ve


