Struktura, svojstva, uporaba i rizici etana
etan je jednostavan ugljikovodik formule C2H6 s prirodom plina bez boje i mirisa koji ima vrlo vrijednu i raznoliku uporabu u sintezi etilena. Osim toga, to je jedan od zemaljskih plinova koji je također otkriven u drugim planetima i zvjezdanim tijelima oko Sunčevog sustava. Otkrio ga je znanstvenik Michael Faraday 1834. godine.
Među velikim brojem organskih spojeva koje tvore ugljikovi i vodikovi atomi (tzv. Ugljikovodici), postoje oni koji su u plinovitom stanju na temperaturama i pritiscima u okolišu, koji se koriste u mnogim industrijama..
Oni obično dolaze iz plinovite mješavine koja se naziva "prirodni plin", proizvod visoke vrijednosti za čovječanstvo, i metan, metan, etan, propan i butan, između ostalih; klasificirani prema količini ugljikovih atoma u svom lancu.
indeks
- 1 Kemijska struktura
- 1.1 Sinteza etana
- 2 Svojstva
- 2.1 Topljivost etana
- 2.2. Kristalizacija etana
- 2.3 Izgaranje etana
- 2.4. Etan u atmosferi i nebeskim tijelima
- 3 Upotreba
- 3.1 Proizvodnja etilena
- 3.2. Osposobljavanje osnovnih kemikalija
- 3.3 Rashladno sredstvo
- 4 Rizici etana
- 5 Reference
Kemijska struktura
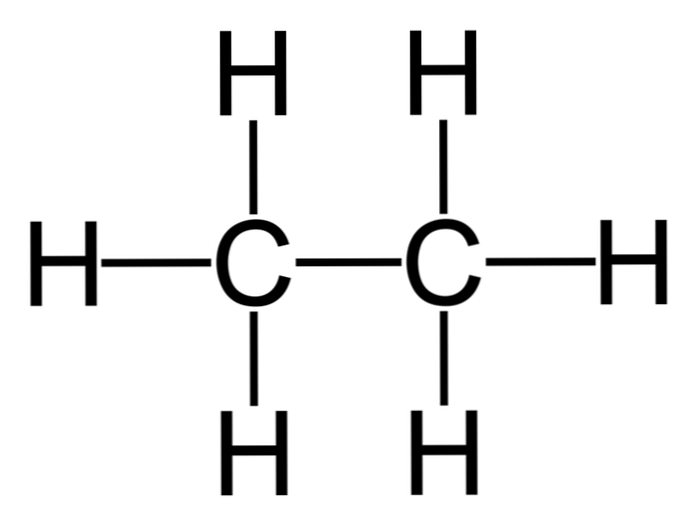
Etan je molekula formule C2H6, tipično se vidi kao spoj dvije metilne skupine (-CH3) da se dobije ugljikovodik jednostavne veze ugljik-ugljik. To je ujedno i najjednostavniji organski spoj nakon metana, prikazan kako slijedi:
H3C = CH3
Atomi ugljika u ovoj molekuli posjeduju sp hibridizaciju3, tako da molekularne veze predstavljaju slobodnu rotaciju.
Također, postoji i unutarnji fenomen etana, koji se temelji na rotaciji molekularne strukture iste i minimalne energije potrebne za proizvodnju rotacije veze od 360 stupnjeva, što su znanstvenici nazvali "etan barijera"..
Iz tog razloga, etan se može pojaviti u različitim konfiguracijama u skladu s njegovom rotacijom, iako njegova stabilnija konformacija postoji tamo gdje su vodici suprotni jedan drugome (kao što je prikazano na slici)..

Sinteza etana
Etan se može lako sintetizirati iz elektrolize Kolbea, organske reakcije u kojoj se odvijaju dva koraka: elektrokemijska dekarboksilacija (uklanjanje karboksilne skupine i oslobađanje ugljičnog dioksida) dvije karboksilne kiseline, te kombinacija produkata. međuprodukte da se formira kovalentna veza.
Slično tome, elektroliza octene kiseline dovodi do stvaranja etana i ugljičnog dioksida, a ova se reakcija koristi za sintezu prvog.
Oksidacija anhidrida octene kiseline djelovanjem peroksida, koncept sličan onom Kolbeove elektrolize, također dovodi do stvaranja etana.
Na isti način, može se učinkovito odvojiti od prirodnog plina i metana procesom ukapljivanja, koristeći kriogene sustave za hvatanje tog plina i odvojiti ga od smjesa s drugim plinovima..
Za tu ulogu poželjan je proces turboekspanzije: mješavina plina prolazi kroz turbinu, stvarajući njezino širenje, sve dok njegova temperatura ne padne ispod -100 ° C.
Već se u ovom trenutku komponente smjese mogu razlikovati, tako da se tekući etan odvaja od plinovitog metana i drugih vrsta uključenih u destilaciju..
nekretnine
Etan se u prirodi javlja kao plin bez mirisa i bez boje pri standardnim tlakovima i temperaturama (1 atm i 25 ° C). Ima vrelište od -88,5 ºC i točku taljenja -182,8 ºC. Osim toga, ne utječe na izloženost jakim kiselinama ili bazama.
Topljivost etanola
Molekule etana su simetrične konfiguracije i imaju slabe sile privlačnosti koje ih drže zajedno, nazivaju se sile disperzije.
Kada se etan pokušava otopiti u vodi, sile privlačenja formirane između plina i tekućine su vrlo slabe, tako da je vrlo teško pridružiti se etanu s molekulama vode..
Iz tog razloga, topljivost etana je znatno niska, lagano se povećavajući kada se tlak sustava podigne.
Kristalizacija etana
Etan se može očvrsnuti, što rezultira stvaranjem nestabilnih kristala etana s kubičnom kristalnom strukturom.
S padom temperature iznad -183,2 ° C, ova struktura postaje monoklinska, povećavajući stabilnost njegove molekule.
Izgaranje etana
Ovaj ugljikovodik, iako nije široko korišten kao gorivo, može se koristiti u procesima izgaranja za proizvodnju ugljičnog dioksida, vode i topline, što je prikazano kako slijedi:
2C2H6 + 7D2 → 4CO2 + 6H2O + 3120 kJ
Postoji i mogućnost sagorijevanja te molekule bez viška kisika, koja je poznata kao "nepotpuna sagorijevanja", a koja rezultira nastajanjem amorfnog ugljika i ugljičnog monoksida u neželjenoj reakciji, ovisno o količini primijenjenog kisika. :
2C2H6 + 3O2 → 4C + 6H2O + Toplina
2C2H6 + 4o2 → 2C + 2CO + 6H2O + Toplina
2C2H6 + 5a2 → 4CO + 6H2O + Toplina
U tom području dolazi do izgaranja kroz niz reakcija slobodnih radikala, koje su numerirane u stotinama različitih reakcija. Na primjer, spojevi kao što su formaldehid, acetaldehid, metan, metanol i etanol mogu se formirati u nepotpunim reakcijama sagorijevanja..
To će ovisiti o uvjetima pod kojima dolazi do reakcije i uključenim reakcijama slobodnih radikala. Etilen se također može formirati na visokim temperaturama (600-900 ° C), što je proizvod koji je industrija visoko poželjna.
Etan u atmosferi i nebeskim tijelima
Etan je prisutan u atmosferi planete Zemlje u tragovima, a sumnja se da je ljudsko biće uspjelo udvostručiti ovu koncentraciju od kada je počeo prakticirati industrijske aktivnosti..
Znanstvenici smatraju da je većina trenutne prisutnosti etana u atmosferi posljedica izgaranja fosilnih goriva, iako je globalna emisija etana smanjena gotovo za polovicu od poboljšanja tehnologije proizvodnje plina iz škriljaca ( izvor prirodnog plina).
Ova vrsta prirodno se proizvodi i djelovanjem sunčevih zraka na atmosferski metan, koji rekombinira i formira molekulu etana.
Etan postoji u tekućem stanju na površini Titana, jednog od Saturnovih mjeseca. To se u većoj količini javlja u rijeci Vid Flumina, koja teče više od 400 kilometara prema jednom od njezinih mora. Također je dokazan ovaj spoj na kometama i na površini Plutona.
aplikacije
Proizvodnja etilena
Uporaba etana temelji se uglavnom na proizvodnji etilena, najraširenijeg organskog proizvoda u svjetskoj proizvodnji, kroz proces poznat kao parni krekiranje..
Ovaj proces se sastoji u propuštanju hrane etana razrijeđenog s parom u pećnicu, brzo zagrijavanje bez kisika.
Reakcija se odvija na ekstremno visokoj temperaturi (između 850 i 900 ° C), ali vrijeme zadržavanja (vrijeme provedeno u etanu u pećnici) mora biti kratko kako bi reakcija bila učinkovita. Pri višim temperaturama nastaje više etilena.
Osposobljavanje osnovnih kemikalija
Etan je također proučavan kao glavna komponenta u formiranju osnovnih kemikalija. Oksidativno kloriranje je jedan od procesa koji se predlaže za dobivanje vinil klorida (komponenta PVC-a), zamjenjujući jeftinije i složenije.
rashladni
Konačno, etan se koristi kao rashladno sredstvo u uobičajenim kriogenim sustavima, također pokazuje sposobnost zamrzavanja malih uzoraka u laboratoriju za analizu.
To je vrlo dobra zamjena za vodu, koja traje duže za hlađenje osjetljivih uzoraka, a također može generirati stvaranje štetnih kristala leda.
Rizici etana
-Etan ima sposobnost zapaljenja, osobito kada se veže s zrakom. U postocima od 3,0 do 12,5% volumena etana u zraku može nastati eksplozivna smjesa.
-Može ograničiti kisik u zraku u kojem se nalazi, i iz tog razloga predstavlja faktor rizika gušenja za ljude i životinje koji su prisutni i izloženi.
-Etan u zamrznutoj tekućoj formi može ozbiljno opeći kožu ako dođe u izravan dodir s njim, a također djeluje kao kriogeni medij za bilo koji predmet koji dodirne, zamrzavajući ga za nekoliko trenutaka.
-Pare tekućeg etana su teže od zraka i koncentrirane su na tlu, što može predstavljati rizik od paljenja koje može izazvati reakciju izgaranja lanca.
-Gutanje etana može izazvati mučninu, povraćanje i unutarnje krvarenje. Udisanje, osim gušenja, uzrokuje glavobolje, zbunjenost i promjene raspoloženja. Smrt zbog srčanog zastoja je moguća pri visokim izlaganjima.
-Predstavlja staklenički plin koji, zajedno s metanom i ugljičnim dioksidom, doprinosi globalnom zagrijavanju i klimatskim promjenama uzrokovanim ljudskim zagađenjem. Srećom, on je manje obilan i izdržljiv od metana i apsorbira manje zračenja od ovoga.
reference
- Britannica, E. (s.f.). Etan. Preuzeto s britannica.com
- Nes, G. V. (s.f.). Jednokristalne strukture i distribucija elektronske gustoće etana, etilena i acetilena. Oporavio se od rug.nl
- Sites, G. (s.f.). Etan: Izvori i sudoperi. Preuzeto s web-lokacije sites.google.com
- SoftSchools. (N. D.). Formula etana. Oporavio se od softschools.com
- Wikipedia. (N. D.). Etan. Preuzeto s en.wikipedia.org


