Kalcijev fosfat (Ca3 (PO4) 2) struktura, svojstva, formacija i uporaba
kalcijev fosfat je anorganska i tercijarna sol čija je kemijska formula Ca3(PO4)2. Formula navodi da je sastav ove soli 3: 2 za kalcij odnosno fosfat. To se može vidjeti izravno na donjoj slici, gdje je prikazana oznaka2+ i anion PO43-. Za sva tri Ca2+ Postoje dva PO43- u interakciji s njima.
S druge strane, kalcijev fosfat se odnosi na niz soli koje variraju ovisno o omjeru Ca / P, kao i stupnju hidracije i pH. Zapravo, postoje mnoge vrste kalcijevih fosfata koji postoje i mogu se sintetizirati. Međutim, doslovno slijedeći nomenklaturu, kalcijev fosfat odnosi se samo na gore spomenuti trikalcijev.

Svi kalcijevi fosfati, uključujući Ca3(PO4)2, Čvrsto su bijele boje s blagim sivkastim tonovima. Oni mogu biti granulirani, fini, kristalni, i veličina čestica je oko mikrometara; i čak su pripremljene nanočestice tih fosfata, s kojima su dizajnirani biokompatibilni materijali za kosti.
Ova biokompatibilnost je posljedica činjenice da se te soli nalaze u zubima i, ukratko, u koštanom tkivu sisavaca. Na primjer, hidroksiapatit je kristalni kalcijev fosfat, koji pak interagira s amorfnom fazom iste soli.
To znači da postoje amorfni i kristalni kalcijevi fosfati. Iz tog razloga, različitost i višestruke mogućnosti nisu iznenađujuće kada se sintetiziraju materijali na bazi kalcijevih fosfata; materijali u čijim su svojstvima istraživači više zainteresirani svakodnevno širom svijeta da se usredotoče na obnovu kostiju.
indeks
- 1 Struktura kalcijevog fosfata
- 1.1 Amorfni kalcijev fosfat
- 1.2 Ostatak obitelji
- 2 Fizikalna i kemijska svojstva
- 2.1 Imena
- 2.2 Molekularna težina
- 2.3 Fizički opis
- 2.4 Okus
- 2.5 Točka taljenja
- 2.6 Topljivost
- 2.7 Gustoća
- 2.8 Indeks loma
- 2.9 Standardna entalpija treninga
- 2.10 Temperatura skladištenja
- 2,11 pH
- 3 Obuka
- 3.1. Kalcijev nitrat i amonijev hidrogen fosfat
- 3.2. Kalcijev hidroksid i fosforna kiselina
- 4 Upotreba
- 4.1 U koštanom tkivu
- 4.2 Biokeramički cementi
- 4.3 Liječnici
- 4.4 Ostalo
- 5 Reference
Struktura kalcijevog fosfata
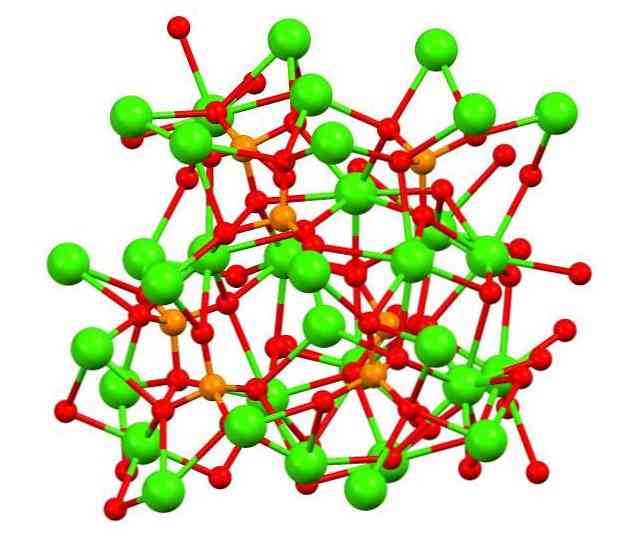
Gornja slika prikazuje strukturu tribazičnog kalkofosfata u čudnom mineralu whitlockite, koji može sadržavati magnezij i željezo kao nečistoće..
Iako na prvi pogled može izgledati složeno, potrebno je pojasniti da model pretpostavlja kovalentne interakcije između atoma kisika fosfata i metalnih centara kalcija.
Kao reprezentativnost vrijedi, međutim, interakcije su elektrostatičke; to jest, kationi Ca2+ privlače PO anioni43- (Ca2+- O-PO33-). Imajući to na umu, razumljivo je zašto su na slici kalcij (zelene sfere) okruženi negativno nabijenim atomima kisika (crvene sfere).
Kada ima toliko iona, ne ostavlja vidljiv simetrični raspored ili uzorak. Ca3(PO4)2 Usvaja se na niskim temperaturama (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, za akronim na engleskom).
Na visokim temperaturama, s druge strane, transformira se u polimorf α-Ca3(PO4)2 (α-TCP), čija jedinična ćelija odgovara monoklinskom kristalnom sustavu. Na još višim temperaturama može se formirati i polimorf α'-Ca3(PO4)2, koji je heksagonalne kristalne strukture.
Amorfni kalcijev fosfat
Spomenute su kristalne strukture za kalcijev fosfat, što se može očekivati od soli. Međutim, ona je sposobna pokazivati neuređene i asimetrične strukture, više povezane s vrstom "stakla kalcijevog fosfata" nego s kristalima u strogom smislu njegove definicije..
Kada se to dogodi, kaže se da kalcijev fosfat ima amorfnu strukturu (ACP, amorfni kalcij fosfat). Nekoliko autora ukazuje na ovu vrstu strukture koja je odgovorna za biološka svojstva Ca3(PO4)2 u koštanom tkivu, moguć je njegov popravak i biomimetizacija.
Utvrđivanjem njegove strukture nuklearnom magnetskom rezonancijom (NMR) pronađena je prisutnost OH iona- i HPO42- u ACP-u. Ovi ioni nastaju hidrolizom jednog od fosfata:
PO43- + H2O <=> HPO42- + OH-
Kao rezultat toga, prava struktura ACP-a postaje sve složenija, čiji je sastav njezinih iona predstavljen formulom: Ca9(PO4)6-x(HPO4)x(OH)x. 'X' označava stupanj hidratacije, jer ako je x = 1, formula bi bila kao: Ca9(PO4)5(HPO4) (OH).
Različite strukture koje PCA može imati ovise o molarnim omjerima Ca / P; to jest, od relativnih količina kalcija i fosfata, koje mijenjaju sav njihov nastali sastav.
Ostatak obitelji
Kalcijevi fosfati su zapravo obitelj anorganskih spojeva, koji pak mogu djelovati s organskom matricom.
Ostali fosfati se dobivaju "jednostavno" promjenom aniona koji prate kalcij (PO43-, HPO42-, H2PO4-, OH-), kao i vrsta nečistoća u krutini. Dakle, do jedanaest kalcijevih fosfata ili više, svaki sa svojom strukturom i svojstvima, može nastati prirodno ili umjetno..
Ispod su neki fosfati i njihove strukture i kemijske formule:
-Vodikov kalcijev fosfat dihidrat, CaHPO42H2O: monoklinska.
-Kalcijev dihidrogen fosfat monohidrat, Ca (H)2PO4)2H2O: triclinic.
-Bezvodni diacidni fosfat, Ca (H)2PO4)2: triclinic.
-Kalcijev hidrogen fosfat (OCP), Ca8H2(PO4)6: triclinic To je prekursor u sintezi hidroksiapatita.
-Hidroksiapatit, Ca5(PO4)3OH: heksagonalna.
Fizikalna i kemijska svojstva
imena
-Kalcijev fosfat
-Tricalcijev fosfat
-Trikalcijev difosfat
Molekularna težina
310,74 g / mol.
Fizički opis
Bijela krutina bez mirisa.
aroma
neukusan.
Točka taljenja
1670 ºK (1391 ºC).
topljivost
-Praktički netopljiv u vodi.
-Netopljiv u etanolu.
-Topivo u razrijeđenoj klorovodičnoj kiselini i dušičnoj kiselini.
gustoća
3,14 g / cm3.
Indeks loma
1629
Standardna entalpija treninga
4126 kcal / mol.
Temperatura skladištenja
2-8 ° C.
pH
6-8 u vodenoj suspenziji od 50 g / L kalcijevog fosfata.
trening
Kalcijev nitrat i vodikov amonijev fosfat
Postoje brojne metode za proizvodnju ili tvorbu kalcijevog fosfata. Jedan od njih se sastoji od mješavine dvije soli, Ca (NO)3)24H2O i (NH4)2HPO4, prethodno otopljen u apsolutnom alkoholu i vodi. Jedna sol daje kalcij, a drugi fosfat.
Iz te smjese taloži se ACP, koji se zatim podvrgne zagrijavanju u peći na 800 ° C i 2 sata. Kao rezultat ovog postupka dobiva se β-Ca3(PO4)2. Pažljivim kontroliranjem temperature, vremena miješanja i vremena kontakta može doći do stvaranja nanokristala.
Da bi se formirao polimorf α-Ca3(PO4)2 potrebno je zagrijavati fosfat iznad 1000 ° C. To zagrijavanje se provodi u prisutnosti drugih metalnih iona koji stabiliziraju taj polimorf dovoljno da se može koristiti na sobnoj temperaturi; to jest, ostaje u stabilnom meta stanju.
Kalcijev hidroksid i fosforna kiselina
Kalcijev fosfat se također može formirati miješanjem otopina kalcijevog hidroksida i fosforne kiseline, s pojavom kiselinsko-bazne neutralizacije. Nakon pola dana zrenja u matičnim lužinama, te pravilnog filtriranja, pranja, sušenja i prosijavanja, dobiva se granulirani prah amorfnog fosfata, ACP.
Ovaj ACP reagira na produkt visokih temperatura, transformirajući se prema sljedećim kemijskim jednadžbama:
2ca9(HPO4) (PO4)5(OH) => 2Ca9(P2O7)0.5(PO4)5(OH) + H2O (pri T = 446.60 ° C)
2ca9(P2O7)0.5(PO4)5(OH) => 3Ca3(PO4)2 + 0.5 H2O (pri T = 748,56 ° C)
Na taj se način dobiva β-Ca3(PO4)2, najčešći i stabilniji polimorf.
aplikacije
U koštanom tkivu
Ca3(PO4)2 To je glavni anorganski sastojak koštanog pepela. To je sastavni dio transplantata za zamjenu kostiju, što se objašnjava njegovom kemijskom sličnošću s mineralima prisutnim u kostima.
Biomaterijali kalcijevog fosfata koriste se za ispravljanje defekata kosti i za premazivanje proteza od titanijuma. Na njima se taloži kalcijev fosfat, izolirajući ih iz okoline i usporavajući proces titracije.
Kalcijevi fosfati, uključujući Ca3(PO4)2, Koriste se za proizvodnju keramičkih materijala. Ovi materijali su biokompatibilni i trenutno se koriste za obnavljanje gubitka alveolarne kosti, što je posljedica parodontne bolesti, endodontskih infekcija i drugih stanja..
Međutim, treba ih koristiti samo za ubrzavanje popravka periapeksnih kostiju u područjima gdje nema kronične bakterijske infekcije.
Kalcijev fosfat može se upotrijebiti u popravljanju oštećenja kostiju, kada nije moguće koristiti autogeni koštani graft. Moguće je koristiti ga sam ili u kombinaciji s biorazgradivim i resorbirajućim polimerom, kao što je poliglikolna kiselina..
Biokeramički cementi
Kalcijev fosfatni cement (CPC) je još jedan biokeramik koji se koristi u popravku koštanog tkiva. Izrađuje se miješanjem praha različitih vrsta kalcijevih fosfata s vodom, formirajući pastu. Pasta se može injektirati ili prilagoditi defektu ili šupljini kosti.
Cementi su oblikovani, postupno se resorbiraju i zamjenjuju novoformiranom kosti.
medicinski
-Ca3(PO4)2 To je bazična sol, pa se koristi kao antacid za neutralizaciju viška želučane kiseline i povećanje pH. U pasti za zube pruža izvor kalcija i fosfata kako bi se olakšao proces remineralizacije zuba i koštane hemostaze..
-Također se koristi kao dodatak prehrani, iako je najjeftiniji način zamjene kalcija upotrebom karbonata i citrata..
-Kalcijev fosfat može se koristiti u liječenju tetanije, latentne hipokalcemije i terapije održavanja. Osim toga, korisna je u suplementaciji kalcija tijekom trudnoće i dojenja.
-Koristi se u liječenju onečišćenja radioaktivnim izotopima radio (Ra-226) i stroncijem (Sr-90). Kalcijev fosfat blokira apsorpciju radioaktivnih izotopa u probavnom traktu, ograničavajući tako njihovu štetu.
drugi
-Kalcijev fosfat se koristi kao hrana za ptice. Osim toga, koristi se u zubnim pastama za kontrolu zubnog kamenca.
-Koristi se kao sredstvo protiv stvrdnjavanja, na primjer, radi sprječavanja zbijanja kuhinjske soli.
-Djeluje kao sredstvo za izbjeljivanje brašna. Dok, u svinjskoj masti svinja sprječava neželjenu boju i poboljšava stanje prženja.
reference
- Tung M.S. (1998) Kalcijevi fosfati: struktura, sastav, topljivost i stabilnost. U: Amjad Z. (eds) Kalcijevi fosfati u biološkim i industrijskim sustavima. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu i Honglian Dai. (2018.). "Sinteza, karakterizacija nano-P-trikalcijevog fosfata i inhibicija stanica hepatocelularnog karcinoma", Journal of Nanomaterials, vol. 2018, ID članka 7083416, 7 stranica, 2018.
- Combes, Krist i Rey, kršćanin. (2010). Amorfni kalcijevi fosfati: sinteza, svojstva i primjena u biomaterijalima. Acta Biomaterialia, vol. 6 (br. 9). str. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalcijev fosfat. Preuzeto s: en.wikipedia.org
- Abida i sur. (2017). Tricalcijev fosfat u prahu: Mogućnost pripreme, karakterizacije i zbijanja. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- Pubchem. (2019). Kalcijev fosfat. Preuzeto s: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Kalcijev fosfat. Science Direct. Preuzeto s: sciencedirect.com


