Formula magnezij hidrida, kemijska struktura i svojstva
magnezij hidrid (MGH2 molekularne formule), je kemijski spoj sa sadržajem u težini vodika od 7,66% i nalazi se u prirodi kao bijela kristalna krutina. Koristi se uglavnom za pripremu drugih kemijskih tvari, iako je također proučavan kao potencijalni medij za skladištenje vodika.
Pripada obitelji slanih (ili ionskih) hidrida, definiranih H-ionom negativno nabijenim. Ti se hidridi smatraju onima koji nastaju od alkalnih metala i zemnoalkalnih metala, ali u slučaju magnezija (i berilija) imaju kovalentne veze, uz one ionike koji karakteriziraju ovu obitelj hidrida.
indeks
- 1 Priprema i formula
- 2 Kemijska struktura
- 3 Fizikalna i kemijska svojstva
- 3.1 Fizički
- 3.2 Kemikalije
- 4 Upotreba
- 4.1 Skladištenje vodika
- 4.2 Reakcije hidrogenacije i dehidrogenacije
- 4,3 Mud
- 4.4 Gorive ćelije
- 4.5. Promet i energija
- 4.6 Alkilacija
- 5 Rizici
- 5.1 Reakcija s vodom
- 5.2 To je piroforno
- 6 Reference
Priprema i formula
Magnezij hidrid nastaje izravnom hidrogenacijom magnezijevog (Mg) metala u uvjetima visokog tlaka i temperature (200 atmosfera, 500 ° C) s MgI katalizatorom.2. Njegova reakcija je jednaka:
Mg + H2→ MgH2
Ispitana je i proizvodnja MgH2 na nižim temperaturama uz upotrebu nanokristalnog magnezija proizvedenog u kugličnim mlinovima.
Postoje i druge metode pripreme, ali one predstavljaju složenije kemijske reakcije (hidrogeniranje magnezij-antracena, reakcija između dietilmagnezija s litij-aluminijevim hidridom, te kao proizvod kompleksa MgH2).
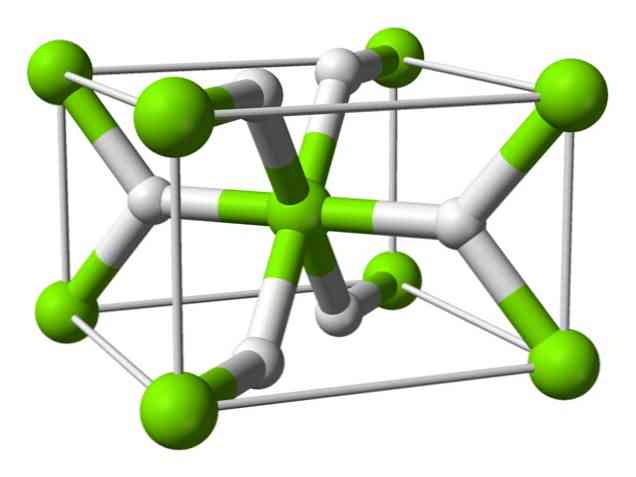
Kemijska struktura
Ovaj atom ima strukturu rutila na sobnoj temperaturi, s tetragonalnom kristalnom strukturom. U uvjetima visokog tlaka ima najmanje četiri različita oblika, a također je primijećena nestehiometrijska struktura s nedostatkom vodika; potonji se javlja samo u vrlo malim količinama čestica kada se formira.
Kao što je gore spomenuto, veze koje postoje u rutilnoj strukturi imaju djelomično kovalentna svojstva umjesto da budu čisto ionska, kao i drugi hidroliti slane otopine..
To uzrokuje da atom magnezija ima sferični oblik, potpuno ioniziran, ali njegov hidridni ion ima izduženu strukturu.
Fizikalna i kemijska svojstva
fizička
- Izgled: Bijeli kristali.
- Molarna masa: 26,3209 g / mol
- Gustoća: 1,45 g / cm3
- Točka taljenja: 285 ° C se raspada
- Topljivost: U vodi se raspada.
Taj kemijski spoj ima molekulsku masu od 26,321 g / mol, gustoću od 1,45 g / cm3 i ima točku taljenja 327 ° C..
kemijski
- Prekursor za proizvodnju drugih kemijskih tvari.
- Skladištenje vodika, kao mogući izvor energije.
- Redukcijsko sredstvo u organskoj sintezi.
Važno je ukazati na to da se ovaj spoj ne može dovesti u tekuće stanje, a kada se prenosi ili talište ili uvodi u vodu, razgrađuje se. Ovaj hidrid je netopljiv u eteru.
To je vrlo reaktivna i lako zapaljiva tvar, a također je piroforna, to jest, može se spontano zapaliti u zraku. Ta tri uvjeta predstavljaju sigurnosne rizike koji će biti spomenuti u posljednjem dijelu ovog članka.
aplikacije
Skladištenje vodika
Magnezij hidrid lako reagira s vodom u obliku plinovitog vodika kroz sljedeću kemijsku reakciju:
MGH2+2H2O → 2H2+Mg (OH)2
Osim toga, ova tvar se razgrađuje na temperaturi od 287 ° C i tlaku od 1 bara, kako slijedi:
MGH2→ Mg + H2
Stoga je predložena upotreba magnezijevog hidrida kao medija za pohranjivanje vodika za njegovu uporabu i transport.
Hidrogenacija i dehidrogenacija količine metalnog magnezija predlaže se kao način prenošenja količina plinovitog vodika, čime se osigurava da nema propuštanja u transportu i predstavlja sigurniji i praktičniji način nego s upotrebom visokotlačnih posuda..
Reakcije hidrogenacije i dehidrogenacije
Iako temperatura razgradnje magnezijevog hidrida predstavlja ograničavajući faktor za njezinu uporabu, predložene su metode za poboljšanje kinetike reakcija hidrogenacije i dehidrogenacije. Jedan od njih je smanjenje veličine čestice magnezija uz korištenje kugličnih mlinova.
blato
Osim toga, predložen je sustav koji proizvodi magnezijev hidrid u obliku blata (lakše i sigurnije nego u prahu ili drugim krutim česticama), koji bi reagirao s vodom da bi se dobio željeni vodik.
Procjenjuje se da bi prethodno imenovani mulj bio formiran fino mljevenim hidridom, zaštićen zaštitnim slojem ulja i suspendiran u dispergirajućim agensima kako bi se osiguralo da zadržava svoju konzistenciju bez gubitka materijala, te da ne apsorbira vlagu iz okoline..
Prednost ovog mulja je u tome što se može pumpati preko bilo koje uobičajene dizelske, benzinske ili vodene pumpe, čineći ovaj ekonomski prijedlog kao i učinkovit.
Gorive ćelije
Magnezij hidrid se može implementirati u proizvodnju naprednih gorivih ćelija, kao iu stvaranje baterija i skladištenje energije.
Prijevoz i energija
Tijekom posljednjih desetljeća razmatrano je korištenje vodika kao izvora energije. Ugradnja vodika kao goriva zahtijeva pronalaženje sigurnih i reverzibilnih sustava skladištenja i visokih volumetrijskih kapaciteta (količina vodika po jedinici volumena) i gravimetrijske (količina vodika po jedinici mase).
alkilacija
Alkilacija (dodavanje CH alkilnih skupina3R) organskih spojeva u bazičnom mediju, gdje je prisutna -OH skupina u niskim koncentracijama i temperatura viša od točke taljenja hidrida.
U ovom slučaju vodici prisutni u magnezijevom hidridu (MgH2), spojiti -OH skupine tvoreći vodu. Slobodni magnezij može primiti halogen koji često prati alkilnu molekulu koja se veže za lanac ugljikovodika..
rizici
Reakcija s vodom
Kao što je već spomenuto, magnezij hidrid je tvar koja vrlo lako i nasilno reagira s vodom, što predstavlja sposobnost eksplodiranja pri višim koncentracijama..
To se događa zato što njegova egzotermna reakcija generira dovoljno topline da upali plin vodika koji se oslobađa u reakciji razgradnje, što dovodi do prilično opasne lančane reakcije..
To je piroforno
Magnezij hidrid je također piroforan, što znači da se može spontano upaliti u prisutnosti vlažnog zraka, te formirati magnezijev oksid i vodu..
Udisanje se ne preporučuje u čvrstom stanju ili u dodiru s parama: tvar u njezinom prirodnom stanju i proizvodi razgradnje mogu uzrokovati ozbiljne ozljede ili čak smrt..
Može stvoriti korozivna rješenja u dodiru s vodom i onečišćenje. Ne preporučuje se kontakt s kožom i očima, a također uzrokuje iritaciju sluznice.
Nije dokazano da magnezijev hidrid može uzrokovati kronične zdravstvene učinke, kao što su rak, reproduktivni defekti ili druge fizičke ili psihičke posljedice, ali se preporučuje uporaba zaštitne opreme (osobito respiratora ili maski, karakter prave prašine).
Prilikom rada s ovom tvari, vlažnost zraka mora se održavati na niskim razinama, gasiti sve izvore zapaljenja i transportirati u bačvama ili drugim kontejnerima za spremnike..
Uvijek treba izbjegavati rad s velikim koncentracijama ove tvari kada se to može izbjeći, jer se mogućnost eksplozije značajno smanjuje.
Ako dođe do izlijevanja magnezijevog hidrida, radno područje treba izolirati, a prašinu pokupiti usisivačem. Nikada nemojte koristiti metodu suhog čišćenja; povećava šanse reakcije s hidridom.
reference
- Zumdahl, S.S. (1998). Encyclopedia Britannica. Preuzeto s britannica.com.
- Pubchem. (2005). PubChem Open Chemistry Database. Preuzeto iz pubchem.ncbi.nlm.nih.gov.
- Siguran vodik, L. (2006). Kongres zelenih automobila. Preuzeto iz greencarcongress.com.
- Chemicals, C. (n.d.). Kemijske kemikalije. Preuzeto iz cameochemicals.noaa.gov.
- Services, N.J. (1987). Odjel za zdravstvo i starije službe u New Jerseyu. Preuzeto iz nj.gov.


