Reakcija saponifikacije i tvari koje se mogu dobiti
saponifikacija To je osnovna hidroliza estera. To znači da ester reagira s bazom (NaOH ili KOH) nepovratno, proizvodeći alkohol i karboksilate natrija ili kalija. Riječ znači "proizvodnja sapuna" i zapravo je jedna od najstarijih kemijskih reakcija koje koristi čovječanstvo.
U babilonskim vremenima, uz pomoć pepela prikupljenog od drva, biljaka i životinjskih masti, oni su usavršili umjetnost izrade sapuna. Zašto životinjske masti? Razlog je taj što je bogat glicerinskim triestrima (trigliceridima), a drveni pepeo je izvor kalija, osnovnog metala.
Inače, reakcija se odvija na nižem prinosu, ali dovoljno da odražava njegove učinke na boje i neke površine. Takav je slučaj s uljem, gdje se pigmenti miješaju s uljem (izvor estera).
indeks
- 1 Reakcija saponifikacije
- 1.1. Mehanizam
- 1.2 Kinetika
- 2 Tvari koje se mogu dobiti saponifikacijom
- 2.1 Otapala sapuna
- 3 Reference
Saponifikacijska reakcija
mehanizam
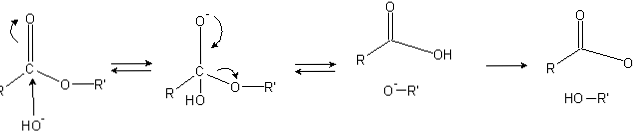
Esteri imaju acilnu skupinu (O = C-R), koja je osjetljiva na nukleofilne napade kao što je OH-.
Budući da atomi kisika "kradu" elektronsku gustoću od atoma ugljika, ona je djelomično nabijena, još više u slučaju estera.
Prema tome, ovaj pozitivni naboj privlači negativne vrste sposobne opskrbljivati elektrone ugljikovom atomu, s nukleofilnim napadom (lijeva strana slike). Kao rezultat, formira se tetraedarski intermedijer (druga molekula s lijeva na desno).
Negativni naboj na kisiku tetraedarskog intermedijera je produkt OH- okružuje. Zatim se taj negativni naboj delokalizira da bi nastao karbonilna skupina, "zatim prisiljavajući" da se prekine veza C-OR. Također, ovo premještanje proizvodi karboksilnu kiselinu RCOOH i alkoksidni ion R'O-.
Konačno, pošto je reakcijski medij bazičan, alkoksid deprotonira jednu molekulu vode i karboksilna kiselina reagira s drugim OH- medija, stvarajući proizvode saponifikacije.
kinetika
Brzina reakcije saponifikacije proporcionalna je koncentracijama reaktanata. Drugim riječima, povećavajući ili koncentraciju estera (RCOOR ') ili bazu (NaOH), reakcija će se odvijati višom brzinom.
Ovo je također prevedeno kako slijedi: brzina saponifikacije je prvi poredak u odnosu na ester, i prvi poredak u odnosu na bazu. Navedeno se može izraziti sljedećom matematičkom jednadžbom:
Brzina = k [RCOOR '] [NaOH]
Gdje je k konstantni ili koeficijent brzine, koji se mijenja kao funkcija temperature ili tlaka; to jest, što je veća toplina, to je veća brzina saponifikacije. Zbog toga je medij pod utjecajem ključanja.
Kako su oba reagensa kinetička prvog reda, ukupna reakcija je drugi poredak.
U reakcijskom mehanizmu saponifikacije, formiranje tetraedarskog intermedijera zahtijeva nukleofilni napad, koji uključuje i ester i bazu.
Stoga se kinetika drugog reda odražava u toj činjenici, jer oni interveniraju u (spor) determinantnom koraku reakcije.
Tvari koje se mogu dobiti saponifikacijom

Glavni proizvodi saponifikacije su alkoholi i soli karboksilnih kiselina. U kiselom mediju dobiva se odgovarajući RCOOH, dobiven saponifikacijom masti i ulja, poznatih kao masne kiseline..
Na taj način sapuni se sastoje od soli masnih kiselina koje nastaju saponifikacijom. Izlazite li s kakvim kationima? Oni mogu biti Na+, K+, mg2+, vjera3+, itd.
Ove soli su topljive u vodi, ali se talože djelovanjem NaCl dodanog u smjesu, koja dehidrira sapun i odvaja ga od vodene faze. Reakcija saponifikacije triglicerida je sljedeća:
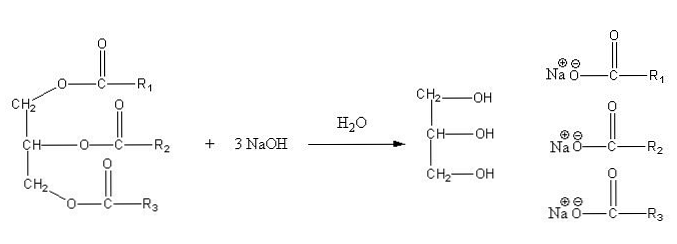
Glicerin je alkoholno "E", a sapun je sve soli nastalih masnih kiselina. Ovdje svaki bočni lanac -R ima različite duljine i stupanj nezasićenosti. Posljedično, ovi lanci čine razliku između masnoća i biljnih ulja.
Ključ za proizvodnju sapuna tada leži u izboru najboljih masti i ulja, ili preciznije, u izboru različitih izvora triglicerida.
Ova bijela sapunasta masa može sadržavati boje i druge organske spojeve u svojoj strukturi, dajući joj ugodne arome i svijetle boje. Odavde, raspon mogućnosti je ukroćen umjetnošću i pozivom u ovoj trgovini.
Međutim, reakcija saponifikacije je također sintetski put karboksilnih kiselina i alkohola koji nisu nužno povezani s glicerinom ili sapunima.
Na primjer, bazična hidroliza bilo kojeg estera, kao što je jednostavan etil acetat, proizvest će octenu kiselinu i etanol.
Otapalo sapuna

Soli masnih kiselina su topljive u vodi, ali ne na isti način kao što su ioni solvatirani; to jest, okružena vodenom sferom. U slučaju sapuna, njihovi bočni lanci -R ih sprječavaju u teoriji od otapanja u vodi.
Dakle, da bi se suprotstavili ovom energetski neudobnom položaju, oni su orijentirani tako da ovi lanci dolaze u kontakt, formirajući nepolarnu organsku jezgru, dok su polarne glave kraj (-COO)- na+), interakciju s molekulama vode i stvaranje "polarne ljuske".
Navedeno je ilustrirano na slici iznad, gdje je prikazan ovaj tip strukture poznat kao micela.
"Crni repovi" odgovaraju hidrofobnim lancima, upleteni u organsku jezgru zaštićenu sivim sferama. Ove sive kugle čine polarni štit, glave - COO- na+.
Zatim, micele su nakupine (nakupine) soli masnih kiselina. Unutar njih se može staviti masnoća koja je zbog svoje apolarne naravi netopljiva u vodi.
Kako to rade? I masni i -R lanci su hidrofobni, tako da oboje imaju veliki afinitet jedan prema drugome.
Kada micele zatvaraju masti, voda stupa u interakciju s polarnom ljuskom, dopuštajući topljivost sapuna. Isto tako, micele su negativno nabijene, uzrokujući međusobno odbijanje i time stvarajući disperziju masti..
reference
- Anne Marie Helmenstine, Ph.D. (3. listopada 2017.) Definicija saponifikacije i reakcija. Preuzeto 24. travnja 2018., s adrese: thoughtco.com
- Francis A. Carey. Organska kemija Karboksilne kiseline. (šesto izdanje, str. 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organska kemija. Lipidi (10. izdanje, Stranica 1056-1058). Wiley Plus.
- Wikipedia. (2018.). Saponifikacije. Preuzeto 24. travnja 2018. s adrese: en.wikipedia.org
- Boyd C. (27. veljače 2015.). Razumjeti kemiju i povijest sapuna. Preuzeto 24. travnja 2018., od: chemservice.com
- Luca Laghi (27. ožujka 2007.) Saponifikacije. Preuzeto 24. travnja 2018. s adrese: commons.wikimedia.org
- Amanda Crochet (12. svibnja 2015.) Micelle (u sivim tonovima). Preuzeto 24. travnja 2018. s adrese: commons.wikimedia.org


