Značajke otopljenih tvari, razlike s otopljenim tvarima i otapalom, primjeri
otopljiva supstanca, u otopini,to je tvar koja se otapa u otapalu. Općenito, otopljena tvar se nalazi u manjem omjeru i može biti kruta, tekuća ili plinovita. Naprotiv, otapalo je komponenta otopine koja je u većoj količini.
Na primjer, u slanoj vodi sol je otopljena i voda je otapalo. Međutim, nisu sve otopljene tvari čvrste ili su otapala tekuća.

U tom smislu postoji nekoliko mogućih kombinacija otopljenih tvari i otapala: plin u tekućini, plin u krutom stanju, tekućina u tekućini, tekućina u krutom stanju, kruta tvar u tekućem ili krutom u krutom stanju.
Da bi se prepoznalo što je otopljeno u rješenju treba uzeti u obzir dva aspekta. Prvo, otopljena tvar je tvar koja je u manjem omjeru. Osim toga, to je ono koje mijenja svoje fizičko stanje (čvrsto, tekuće ili plinovito) kada je integrirano u otopinu.
indeks
- 1 Otopine, otapala i otopljene tvari
- 2 Definicija otopljene tvari
- 3 Značajke
- 3.1 Topljivost
- 3.2 Temperatura
- 3.3 Zasićenje otopine
- 3.4 Pritisak
- 3.5 Polaritet
- 4 Razlike između otopljene tvari i otapala
- 5 Primjeri otopljene tvari
- 5.1 Otopina u plinovitom stanju
- 5.2 Otopine u krutom stanju
- 5.3 Otopine u tekućem stanju
- 5.4 Rješenja koja se mogu koristiti kod kuće
- 6 Reference
Otopine, otapala i otopljene tvari
U kemiji postoje homogene mješavine, koje su svojim sadržajima podijeljene u jednake dijelove. Jedna od najčešćih vrsta homogenih smjesa su otopine koje su stabilne homogene smjese dviju ili više tvari, pri čemu se otopljena tvar otapa u otapalu..
Rješenja, otapala i otopljene tvari promatraju se u svakodnevnim situacijama iu rasponu koji varira od industrijske do laboratorijske. Ove tvari nastale iz mješavina su predmet istraživanja zbog karakteristika koje su prisutne i sila i / ili atrakcija koje se pojavljuju između njih..
Definicija otopljene tvari
Kao što je gore navedeno, otopljena tvar je ona tvar koja se otapa u drugu, koja se naziva otapalo.
Obično otopljena tvar ima manji udio i može se pojaviti u bilo kojem od tri stanja tvari. Kada je dano rješenje između dvije tvari koje su u istoj fazi, metoda odabira koja se u manjem omjeru koristi za određivanje koja je otopljena tvar i koja je otapalo.
Kapacitet otapanja otopljene tvari ovisi o topljivosti. Temperatura otapala također predstavlja odlučujući faktor kada je u pitanju mogućnost formiranja ili ne otopine, budući da što je viša temperatura otapala, to je veća količina otopljene tvari koja se može otopiti u ovoj otopini..
Postoje tvari koje se nazivaju površinski aktivne tvari koje postaju manje topljive pri višim temperaturama, ali su iznimke i ispunjavaju određene uloge.
Postupak u kojem otapalo međudjeluje s otopljenom tvari radi stvaranja otopine definira se kao solvatacija, a uključuje stvaranje veza i vodikovih mostova, pored atrakcija po van der Waalsovim silama..
značajke
Otapala sadrže ogromnu raznolikost kemijskih tvari u različitim stanjima, imaju različite kapacitete otapanja i imaju brojne karakteristike koje igraju važnu ulogu u stvaranju homogenih smjesa. Neke od glavnih značajki otopljenih tvari su sljedeće:
topljivost
Topljivost je sposobnost spoja da se otopi u drugoj tvari. Ta sposobnost ima blisku vezu s mješljivošću, koja je sposobnost tekućine da se miješa s određenom; Ako se ne možete pridružiti, to je nemjerljivost.
Mješljivost ima raspon veći od određenog broja, tako da se može reći da se jedna tvar u potpunosti, djelomično ili ne miješa u drugoj.
Topljivo svojstvo otopljene tvari ovisi, opet, o drugim čimbenicima koji mogu povećati ili smanjiti taj kapacitet zbog utjecaja ovih na ravnotežu intermolekularnih sila koje nastaju između otopljene tvari i otapala..
Čak i manje očekivane osobine, kao što je veličina kapi otopljene tvari ili red u strukturi kristala, mogu utjecati na njihovu sposobnost otapanja.
temperatura
Temperatura sustava u kojem se otopljena tvar može utjecati na njezinu topljivost: kod većine krutina i tekućina one povećavaju svoj kapacitet otapanja u skladu s povećanjem temperature.
Nasuprot tome, u plinovima se promatra složeno ponašanje koje je prikazano kao niža topljivost u vodi pri višim temperaturama, ali veća u organskim otapalima..
Zasićenje otopine
To se naziva zasićenje otopine do stupnja u kojem je otopina otopila otopljenu tvar, nazvana zasićena otopina onome što je otopljeno što je više moguće otopljene tvari. Od tog trenutka, dodana otopljena tvar će se istaložiti kao suvišak na dnu korištenog spremnika; prije toga, otopina se naziva nezasićena.
Moguće je proći točku zasićenja i nastaviti rastapati otopljenu tvar, ali to zahtijeva povećanje temperature. Otopina koja sadrži višak otopljene tvari i koja je zagrijana naziva se prezasićena otopina.
pritisak
Promjene tlaka obično ne utječu na topljivost krutih tvari i tekućina, osim u nekim iznimnim slučajevima (akumulacija kalcijevog sulfata u naftnim cijevima), ali u plinovima je odlučujući čimbenik njihove sposobnosti otapanja.
Zapravo, topljivost plina u otapalu je izravno proporcionalna parcijalnom tlaku tog plina na navedenom otapalu.
polaritet
Polaritet otopljene tvari je presudan pri mjerenju njegove sposobnosti otapanja; otopljena tvar će se bolje otopiti u otapalu s kemijskom strukturom sličnom onoj koju ima.
Na primjer, visoko polarne ili hidrofilne tvari imat će veću topljivost u visoko polarnim otapalima, dok će one biti praktički netopljive u nepolarnim tvarima..
Slično tome, intermolekularne sile igraju važnu ulogu u solvataciji i lakoći s kojom otapalo može otopiti otopljenu tvar: veće dipol-dipolske sile, vodikove veze i druge veze, veća sposobnost otapala za otapanje otopiti i oblikovati otopinu.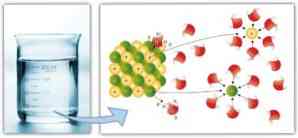
Razlike između otopljene tvari i otapala
- Rastvor je tvar koja je otopljena; otapalo je sredstvo za otapanje otopljene tvari.
- Otopina može biti u krutoj, tekućoj ili plinskoj fazi; otapalo je obično u tekućoj fazi, ali također postoji u krutom i plinovitom stanju.
- Topljivost otopljene tvari više ovisi o svojstvima kao što je površina; Kapacitet solvata ovisi o drugim polaritetima, temperaturi i tlaku.
- Otopina je obično željena komponenta koja se ekstrahira u industrijskim procesima; Otapalo obično nije željena komponenta i odbacuje se u industrijskim procesima.
Primjeri otopljene tvari
- Šećer je primjer čvrste faze koja se obično koristi za zasladivanje vode.
- Heksan se može naći u parafinskom vosku, služeći kao tekuća otopina koja čini ovu krutu krutu.
- Ugljični dioksid je plin koji se dodaje u napitke kako bi se dobilo pjenušavost.
Otopina u plinovitom stanju
Ugljični dioksid u vodi (bezalkoholna pića)
Ugljična voda je voda koja sadrži ugljični dioksid i nastaje prenošenjem ugljičnog dioksida pod pritiskom kroz vodu.
Gazirane mineralne vode nastaju prirodno već dugo vremena. Ove šumeće vode postoje zbog viška ugljičnog dioksida u vodonosniku koji se otopio pod pritiskom.
Jedan od najpoznatijih primjera otopljenih tvari je komercijalno bezalkoholno piće koje se kombinira sa sirupom.
Prisutnost ugljičnog dioksida čini ove vode i bezalkoholna pića privlačnijima i vizualno privlačnijima.
Kisik i drugi plinovi u dušiku (zraku)
Zrak u atmosferi sastoji se od molekula različitih plinova. U osnovi se sastoji od 78% dušika i oko 21% kisika (otopljene tvari). Osim toga, sadrži gotovo 1% argona i drugih molekula, ali u vrlo malim količinama.
Propan u butanu (plin za kuhanje)
Ova kombinacija, poznata i kao ukapljeni naftni plin (LPG), počela se koristiti od 1860. kao izvor goriva za kućne potrebe..
Od tada je proširila svoju proizvodnju i potrošnju za kućnu i industrijsku uporabu. Budući da su oba plina iznimno bez mirisa i opasna, dodaje se tvar koja se naziva merkaptan, što čini svako propuštanje vidljivo..
Otopina u čvrstom stanju
Bakreni cink (mjed)
Komercijalna legura poznata kao mesing nastaje od cinka (od 5 do 40%) otopljenog u bakru. Cink pomaže povećanju vlačne čvrstoće. Ostalim elementima kao što su kositar, željezo, aluminij, nikal i silicij mogu se dodati ove legure.
Jod u alkoholu (tinktura joda)
Još jedan primjer popularne tvari je jodna tinktura. Ova otopina sadrži jod u etilnom alkoholu (od 44 do 50%). Jodna tinktura se koristi kao antiseptik.
Sol u vodi (morska voda)
Morska voda pokriva više od 70% površine Zemlje. To je složena smjesa od 96,5% vode, 2,5% soli i manjih količina drugih tvari. To uključuje anorganske i otopljene organske materijale, čestice i neke atmosferske plinove.
Otapala u tekućem stanju
Alkohol u vodi (alkoholna pića)
Etanol ili etilni alkohol (otopljena tvar) iz fermentacije šećera miješa se s vodom u fiksnim omjerima radi proizvodnje alkoholnih pića.
Ovaj spoj lako se probavlja u tijelu, ali njegova potrošnja u višku može prouzročiti ozbiljno oštećenje zdravlja.
Voda u zraku (vlaga u zraku)
Voda u zraku je obično poznata kao magla. To je uzrokovano malim kapljicama vode suspendirane u zraku, i to je u osnovi zbog hlađenja zemlje tijekom noći.
Na taj način hlađenje uzrokuje smanjenje okolnog zraka. Zatim se javlja fenomen kada se u tome zadržava kondenzirana voda.
Octena kiselina u vodi (ocat)
Ocat je tekućina s oštrim okusom koji se koristi za dodavanje okusa ili očuvanje hrane. Priprema se pomoću otopine octene kiseline pomiješane s vodom.
Koncentracija octene kiseline je promjenjiva. Na primjer, destilirani ocat ima omjer koji ide od 5 do 8%.
Živa u srebru (amalgami ili zubni ispuni)
Amalgami koji se koriste za zubne plombe tvore 2% žive s legurom koja djeluje kao otapalo. Ova legura sadrži 70% srebra. Također možete dodati kositar, bakar i cink.
Solutos koji se može koristiti kod kuće
Šećer u vodi
Šećer je molekularni i polarni spoj i kao takav ima sposobnost otapanja u vodi, koja je također polarni element.
Način na koji je šećer strukturiran uzrokovat će promjenu postupka otapanja. Na primjer, ako je šećer u kvržicama, potrebno je više vremena da se otopi nego ako je u zrnu.
Neki stručnjaci vjeruju da je voda sa šećerom vrlo važan izvor energije za tijelo. Postoje čak i studije koje otkrivaju učinkovitost ovog rješenja u osoba koje obavljaju fizičku aktivnost.
Šećer u brašnu
Uobičajeno je za pripremu kolača najprije miješati čvrste sastojke, a zatim dodati tekućine.
Šećer je otopljena tvar koja je pričvršćena na brašno, što dovodi do nastanka mješavine za kolač. Osim ova dva sastojka, drugi se dodaju kasnije, kao što su jaja, maslac ili vanilija.
Ovaj tip otopljene tvari je krut i u ovom slučaju se miješa s otapalom koje je također kruto. Rezultirajuća baza se također može koristiti za izradu slatkih kruhova, kolača, kolača, kolača od spužva, malih pudinga i mnogih drugih slatkih namirnica..
Sok u prahu u vodi
Postoji širok raspon sokova u prahu koji se pripremaju otapanjem ovog elementa u vodi. U tom slučaju otopljena tvar je prah za sok, a otapalo je voda.
Količina otapala mora biti veća od količine otapala, tako da se obično jedna ili dvije žlice praha soka rastvore u čaši vode. Čak postoje i neki prašci čija je koncentracija viša i potrebno je koristiti manju količinu.
Postoje klevetnici tih sokova, jer oni ukazuju da su sastojci koje oni uključuju (kao konzervansi, stabilizatori i sladila, među ostalima) štetni za zdravlje.
Klor u vodi
Jedan od načina pročišćavanja vode je korištenje klora kao otopljene tvari u vodi. Ovo sredstvo za dezinfekciju karakterizirano je kao jedno od najčešće korištenih u uklanjanju mikroba i idealno je da se voda za piće pretvori u pitku na brz, ekonomičan i jednostavan način..
Klor kao otopinu ove otopine treba ugraditi u vodu u koncentraciji ne većoj od 0,2 i 0,5 miligrama po litri.
Količina klora koja se koristi trebala bi biti vrlo niska, jer ta tvar može biti vrlo toksična kada se konzumira ili je izložena mnogim količinama.
Ova metoda pročišćavanja vode poznata je kao kloriranje, a može se primijeniti usred izleta na planinu ili tretirati vodu u kući, kako bi se uklonile bakterije i mikrobi koji se mogu naći u cijevima kroz koje prolazi voda..
Slikanje u vodi
Voda je univerzalno otapalo koje postoji i ono je također osnova na kojoj se otopi otopljena tvar kao što je boja.
Boja se obično otapa iz različitih razloga. Najčešći je olakšavanje čišćenja četkica i drugih alata za bojenje.
Postoje mnoge vrste slika; One koje se najbolje rastapaju u vodi su one s lateksom. Osim što omogućuje bolje čišćenje alata, prednost razrjeđivanja boje u vodi prije početka farbanja je da će jamčiti bolju završnu obradu na obojenoj površini..
Mlijeko u prahu u vodi
Mlijeko u prahu je otopljena tvar koja nastaje dehidracijom mlijeka koje je već pasterizirano. Svrha ovog postupka je osigurati da se mlijeko može duže skladištiti.
Ova otopljena tvar se otapa u vodi i stvara tekuće mlijeko koje se obično uzima za vrijeme doručka, zajedno s kavom ili u raznim pripravcima.
Kao u slučaju praha soka, količina mlijeka za razrjeđivanje mora biti manja od količine vode u kojoj želite pripremiti otopinu.
Deterdžent u vodi
Prilikom pranja odjeće koriste se tekući ili praškasti deterdženti. One se otapaju u vodi kako bi se dobila otopina koja djeluje kao dezinfekcijsko sredstvo i sredstvo za čišćenje tekstilnih tkanina.
Količina otopljene tvari koja se mora upotrijebiti u ovoj otopini varijabilna je, ovisno o vrsti deterdženta, prikazu iste i komponenti koje ima.
Rješenje koje se sastoji od deterdženta i vode može biti vrlo zagađujuće kada dođe u dodir s vodenim odlagalištima, pa je preporučljivo koristiti biorazgradive deterdžente, koji se mogu razgraditi u vrlo kratkom vremenu i utjecati mnogo manje na okoliš.
želatin
Želatin je element sastavljen od tetiva, ligamenata i životinjskih kostiju. Ovaj spoj može biti u prahu ili u listovima.
U oba slučaja, otopljena tvar se mora otopiti u vrućoj vodi kako bi se postigao konačni rezultat: slatka hrana idealna za desert i uz mnoge zdravstvene prednosti.
Među prednostima ovog spoja je i to što pogoduje brzom popravku tkiva i predstavlja protuupalnu hranu. Osim toga, ima veliku količinu proteina i igra važnu ulogu u utvrđivanju imunološkog sustava.
Jedenje dnevne količine želatine pomoći će regenerirati zglobove i tako predvidjeti pojavu osteoporoze..
Čokolada u mlijeku
Čokolada je element koji nastaje zahvaljujući mješavini kakao i maslaca od kakaa. Ova hrana djeluje kao otopljena tvar kada se pomiješa s mlijekom za pripremu onoga što se obično naziva vruća čokolada.
Za ovaj pripravak zagrijava se željena količina mlijeka i dodaje se čokolada, u komadima, u prahu ili tekućini, uz stalno miješanje.
Kako bi se otopljena tvar otopila na najbolji mogući način i izbjegavala kvržice, potrebno je da se mješavina istisne bez pauze.
Kakao prah u vodi
Također možete pripremiti vruću čokoladu pomoću kakao praha. Ova otopljena tvar nastaje samo od mase praškastog kakaa. Za razliku od čokolade, kakao ne uključuje maslac ovog voća.
Kakao se može savršeno otopiti u vodi kako bi se dobilo piće s okusom čokolade. U tim je slučajevima bitno da se smjesa zasladi šećerom, medom ili nekim sladilom; inače će rezultat biti izuzetno gorak.
reference
- Lambert, N. i Mohammed, M. (1993). Kemija za CXC. Oxford: Heinemann.
- Steen, D.P. (2008). Ugljični dioksid, karbonacija i principi tehnologije punjenja. U D. P. Steenu, Philipu i P. R. Ashurstu (urednici), gazirana bezalkoholna pića: formulacija i proizvodnja, str. 112-143. Oxford: izdavaštvo Blackwell.
- Što je u zraku? (s / f). UCAR Centar za znanstveno obrazovanje. Preuzeto 17. listopada 2017. iz eo.ucar.edu
- Ukapljeni naftni plin. (2013., 12. srpnja). Encyclopædia Britannica.
Preuzeto 16. listopada 2017. iz britannica.com - Lytle, D.A. i Schock, M.R. (1996). Vrijeme stagnacije, sastav, učinci PH i ortofosfat na izlučivanje metala iz mjedi. Ohio: SAD Agencija za zaštitu okoliša.
- Crabwee, T.D. Pelletier, S.J. i Pruett, T.L. (2001). Kirurški Antisepsis U S. S. Block (urednik), Dezinfekcija, sterilizacija i očuvanje, str. 919-934. Philadelphia: Lippincott Williams & Wilkins.
- Byrne, R.H. i sur. (2017., 7. lipnja). Morska voda. Encyclopædia Britannica. Preuzeto 17. listopada 2017. s britannica.com
- Plutowska B. i Wardencki, W. (2012). Plinska kromatografija-olfaktometrija alkoholnih pića. U J. Piggott (urednik), Alkoholna pića: senzorska evaluacija i istraživanje potrošača, str.101-122. Philadelphia: Izdavačka kuća Woodhead.
- Što je magla? (2017., 12. srpnja). Met Office (UK). metoffice.gov.uk
- Helmenstine, A. M ... (2016., 16. veljače). Što je kemijski sastav octa? Preuzeto 17. listopada 2017., iz thoughtco.com
- Phinney, D.J. i Halstead, J.H. (2017). Stomatološka pomoć: sveobuhvatni pristup. Massachusetts: Cengage učenje.
- Britannica, E. (s.f.). Rješenje-kemija. Preuzeto s britannica.com
- Wikipedia. (N. D.). Topivost. Preuzeto s en.wikipedia.org
- Classzone. (N. D.). Otopljene tvari. Preuzeto s frsd.k12.nj.us
- ChemGuide. (N. D.). Zasićene otopine i topljivost. Preuzeto s chem.libretexts.org
- Madhusha. (N. D.). Razlika između otapala i otapala. Preuzeto s pediaa.com.


