Formule natrijevog sulfida, upotrebe, rizici
natrijev sulfid (Na2S) je kristalna krutina od žute do crvene boje. U prirodi se nalazi u različitim stupnjevima hidratacije, a najčešći je natrijev sulfid nonahidrat (Na2S · 9H2O).
To su vodotopive soli koje daju jako alkalne otopine. Kada su izloženi vlažnom zraku, oni upijaju vlagu iz zraka, koja se može spontano zagrijati i izazvati paljenje obližnjih zapaljivih materijala. Isto tako, u dodiru s vlažnim zrakom emitiraju sumporovodik, koji miriše na pokvarena jaja.

Oni su jaki redukcijski agensi. Ove tvari mogu biti opasne za okoliš, osobito za vodene organizme.
Natrijev monosulfid je komercijalno dostupan u obliku pahuljica koje sadrže 60-62% Na2S ...
- formula

- CAS: 1313-82-2 Natrijev sulfid (bezvodni)
- CAS: 1313-84-4 Natrijev sulfid (nonahidrated)
2D struktura
3D struktura
Značajke natrijevog sulfida
Fizikalna i kemijska svojstva

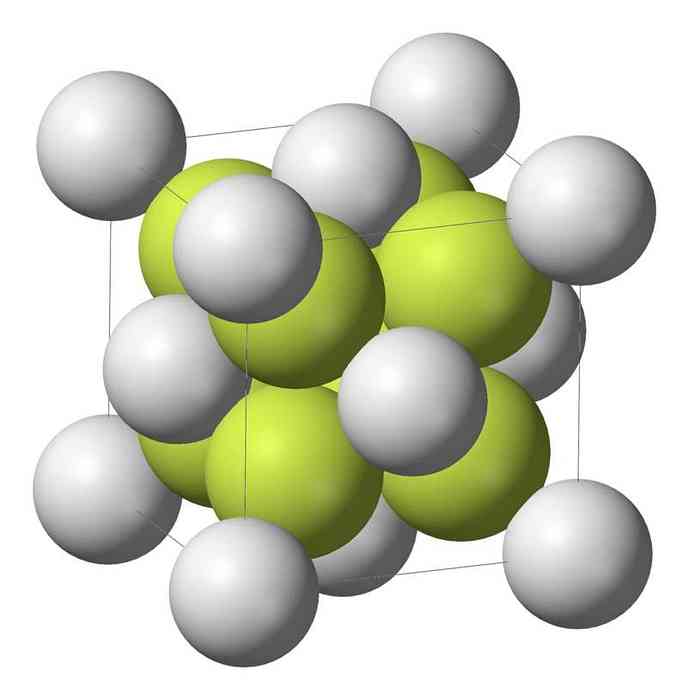
Natrijev monosulfid (Na2S) kristalizira s antifluoritnom strukturom, u kojoj je svaki S atom okružen kockom od 8 Na-atoma, a svaki Na-atom je tetraedarski od 4 S atoma..
zapaljivost
Jedini vrlo zapaljivi član u skupini anorganskih sulfida je sumporovodik. Međutim, neki drugi anorganski sulfidi, kao što je natrijev sulfid, mogu se spontano zagrijati i čak zapaliti ako su izloženi vlazi..
Kada je izložen vatri, natrijev sulfid ispušta plinove ili pare sumpornog dioksida koji su iritantni ili otrovni.
reaktivnost
- Anorganski sulfidi su općenito bazični (neki su jako bazični, te stoga nisu kompatibilni s kiselinama).
- Mnogi od tih spojeva su reducensi (oni snažno reagiraju s oksidirajućim agensima).
- Jednostavne soli sulfida (kao što su natrij, kalij i amonijev sulfid) energično reagiraju s kiselinama kako bi se oslobodio visoko toksičan i zapaljiv plin vodikov sulfid.
- Natrijev sulfid je zapaljiv. Može eksplodirati kada se brzo zagrije ili pogodi.
- Kada se zagrije do razgradnje, ispušta toksične pare natrijevog oksida i sumpornih oksida.
- Burno reagira s ugljikom, ugljenom, diazonijevim solima, N, N-diklorometilaminom, jakim oksidansima i vodom.
toksičnost
Mnogi članovi skupine anorganskih sulfida ponašaju se kao jake baze i mogu izazvati teške opekline kada dođu u kontakt s kožom.
To svojstvo ovisi o njegovoj topljivosti. Neotopljeni anorganski sulfidi (na primjer, živin (II) sulfid i kadmijev sulfid) nisu kaustični.
Natrijev sulfid ima medij za raspodjelu oktanol / voda (Pow) (-3,5). Ova se vrijednost upotrebljava kao mjera topljivosti (i biokoncentracije) tvari u životinjskim masnim tkivima (osobito vodenim životinjama).
Smatra se da je natrijev sulfid opasan za okoliš, osobito za vodene organizme.
aplikacije
Kod kuće se natrijev sulfid koristi u otkrivanju cijevi, sredstava za čišćenje u kućanstvu (za peć, kupaonicu), uređaja za ravnanje kose, sapuna za posuđe i automatskih zračnih jastuka..
U industriji se koristi u sredstvima za čišćenje, u cementu i kao prekursor u proizvodnji drugih kemijskih proizvoda.
Klinički učinci
Izlaganje natrijevom sulfidu uobičajeno je u razvijenim zemljama i nerazvijenim zemljama, kako u industriji, tako i kod kuće. Ove korozivne tvari prisutne su u nekoliko proizvoda za kućanstvo u niskoj koncentraciji.
U razvijenim zemljama ozbiljni učinci su rijetki. Do njih dolazi uglavnom zbog namjernog gutanja kemikalije u odraslih. Međutim, u zemljama u razvoju ozbiljniji učinci su češći.
Alkalne korozivne tvari uzrokuju nekrozu zbog ukapljivanja. Saponiziraju masti u staničnoj membrani, uništavajući stanicu i dopuštajući duboko prodiranje u tkivo sluznice.
Oralna izloženost
Početna upala javlja se u gastrointestinalnom tkivu, nakon čega slijedi nekroza tkiva (s mogućom perforacijom), zatim granulacija i konačno formiranje stenoze..
Bolesnici s blagim gutanjem razvijaju iritaciju ili opekline I. stupnja (površinska hiperemija i edem) orofarinksa, jednjaka ili želuca.
Bolesnici s umjerenom intoksikacijom mogu razviti opekline II stupnja (površinski mjehurići, erozije i ulceracije) s mogućim daljnjim formiranjem stenoze (osobito ezofagealne)..
Neki pacijenti (osobito mala djeca) mogu razviti edem u gornjim dišnim putovima.
Bolesnici s teškom intoksikacijom uslijed gutanja mogu razviti duboke opekline i nekrozu sluznice probavnog sustava, s komplikacijama kao što su: perforacija (jednjak, želudac, rijetko duodenal), stvaranje fistule (traheoezofagealni, aortezofagealni) i gastrointestinalno krvarenje.
Mogu se razviti: hipotenzija, tahikardija, tahipnea, formacija strikture (uglavnom ezofagealne), karcinom jednjaka i edemi gornjih dišnih putova (što je uobičajeno i često ugrožavaju život).
Teško trovanje uglavnom je ograničeno na namjerno uzimanje odraslih osoba.
Izlaganje udisanjem
Blaga izloženost može uzrokovati kašalj i bronhospazam.
Jako udisanje može uzrokovati edem gornjih dišnih puteva, opekotine, stridor i, rijetko, akutnu ozljedu pluća..
Izlaganje očiju
Može uzrokovati tešku iritaciju konjunktive i kemozu, oštećenja epitelija rožnice, limbičku ishemiju, trajni gubitak vida i teške slučajeve perforacije..
Izlaganje kože
Blaga izloženost uzrokuje iritaciju i djelomične opekline. U bolesnika s teškim opeklinama ili šokom može se razviti metabolička acidoza.
Dugotrajno izlaganje ili proizvodi visoke koncentracije mogu uzrokovati opekline ukupne debljine.
Sigurnost i rizici
Izjave o opasnostima globalno usklađenog sustava za razvrstavanje i označavanje kemikalija (DGU)
Globalno harmonizirani sustav za razvrstavanje i označavanje kemikalija (DGU) je međunarodno dogovoreni sustav koji su stvorili Ujedinjeni narodi i zamišljen različitim standardima klasifikacije i označavanja koji se koriste u različitim zemljama korištenjem dosljednih kriterija širom svijeta..
Razredi opasnosti (i njihovo odgovarajuće poglavlje GHS-a), standardi razvrstavanja i označavanja te preporuke za natrijev sulfid su kako slijedi (Europska agencija za kemikalije, 2017., Ujedinjene nacije, 2015., PubChem, 2017):







reference
- Benjah-bmm27, (2006). Fluorit-unit-cell-3D-ionic [image] Preuzeto s: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Preuzeto s: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktura 1313-82-2 - natrijev sulfid [image] Dobavljeno iz: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktura 1313-84-4 - natrijev sulfid [image] Dobavljeno iz: chem.nlm.nih.gov.
- Europska agencija za kemikalije (ECHA). (2017). Sažetak klasifikacije i označavanja.
- Harmonizirano razvrstavanje - Prilog VI Uredbe (EZ) br. 1272/2008 (Uredba CLP). Natrijev sulfid. Preuzeto 16. siječnja 2017., s adrese: echa.europa.eu.
- Europska agencija za kemikalije (ECHA). (2017). Sažetak klasifikacije i označavanja.
- Prijavljeno razvrstavanje i označavanje. Natrijev sulfid, hidriran. Preuzeto 16. siječnja 2017., s adrese: echa.europa.eu.
- Banka podataka o opasnim tvarima (HSDB). TOXNET. (2017). Natrijev sulfid. Bethesda, MD, EU: Nacionalna medicinska knjižnica. Preuzeto s: toxnet.nlm.nih.gov.
- Lange, L., i Triebel, W. (2000). Sulfidi, polisulfidi i sulfani. U Ullmannovoj Enciklopediji industrijske kemije. Wiley-VCH Verlag GmbH & Co. KGaA. Preuzeto s stranice dx.doi.org.
- Ujedinjeni narodi (2015.). Globalno harmonizirani sustav za razvrstavanje i označavanje kemijskih proizvoda (DGU) Šesto revidirano izdanje. New York, Sjedinjene Države: publikacija Ujedinjenih naroda. Preuzeto s: unece.org.
- Nacionalni centar za biotehnološke informacije. PubChem Compound baza podataka. (2016). Natrijev sulfid enneahydrate - PubChem Structure [image] Preuzeto s: pubchem.ncbi.nlm.nih.gov.
- Nacionalni centar za biotehnološke informacije. PubChem Compound baza podataka. (2017). Natrijev monosulfid. Bethesda, MD, EU: Nacionalna medicinska knjižnica. Preuzeto s: pubchem.ncbi.nlm.nih.gov.
- Nacionalni centar za biotehnološke informacije. PubChem Compound baza podataka. (2017). Natrijev sulfid enneahidrat. Bethesda, MD, EU: Nacionalna medicinska knjižnica. Preuzeto s: pubchem.ncbi.nlm.nih.gov.
- Nacionalna administracija za oceane i atmosferu (NOAA). CAMEO Kemikalije. (2017). Tehnički list. Natrijev sulfid, bezvodni. Silver Spring, MD. EU-a; Preuzeto s: cameochemicals.noaa.gov.
- Nacionalna administracija za oceane i atmosferu (NOAA). CAMEO Kemikalije. (2017). Reaktivni skup podataka grupe. Sulfidi, anorganski. Silver Spring, MD. EU-a; Preuzeto s: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Preuzeto s: wikipedia.org.
- PubChem, (2016). Natrijev monosulfid [image] Dobavljeno iz: puchem.nlm.nih.gov.
- PubChem, (2016). Natrijev sulfid enneahydrate [image] Preuzeto s: puchem.nlm.nih.gov.
- Wikipedia. (2017). Koeficijent raspodjele oktanol-voda. Preuzeto 17. siječnja 2017., s: wikipedia.org.
- Wikipedia. (2017). Natrijev sulfid. Preuzeto 17. siječnja 2017., s: wikipedia.org.


