Karakteristike ugljikovog atoma, struktura, hibridizacija, klasifikacija
ugljikov atom Ona je možda najvažnija i najznačajnija od svih elemenata, jer je zahvaljujući njoj moguće postojanje života. U sebi obuhvaća ne samo nekoliko elektrona, ili jezgru s protonima i neutronima, već i zvjezdanu prašinu, koja završava uklopljenim i formira živa bića..
Također, ugljikovi atomi nalaze se u Zemljinoj kori, iako ne s obiljem usporedivim s metalnim elementima kao što su željezo, karbonati, ugljični dioksid, ulje, dijamanti, ugljikohidrati itd. njegove fizičke i kemijske manifestacije.
Ali kako je atom ugljika? Prva netočna skica je ona koja se vidi na slici iznad, čije su karakteristike opisane u sljedećem odjeljku.
Atomi ugljika putuju kroz atmosferu, mora, podzemlje, biljke i sve životinjske vrste. Njegova velika kemijska raznolikost posljedica je visoke stabilnosti njezinih veza i načina na koji su uređene u prostoru. Tako, s jedne strane, ima glatki i podmazujući grafit; as druge strane, dijamant, čija tvrdoća nadmašuje tvrdoću mnogih materijala.
Ako ugljikov atom nije imao kvalitete koje ga karakteriziraju, organska kemija ne bi postojala u potpunosti. Neki vizionari u njoj vide nove materijale budućnosti, kroz dizajn i funkcionalizaciju njegovih alotropnih struktura (ugljikove nanocijevi, grafen, fulereni itd.).
indeks
- 1 Karakteristike ugljikovog atoma
- 2 Struktura
- 3 Hibridizacija
- 3.1 sp3
- 3.2 sp2 i sp
- 4 Klasifikacija
- 4.1 Primarni
- 4.2 Sekundarno
- 4.3 Tercijarni
- 4.4 kvartar
- 5 Upotreba
- 5.1 Jedinica atomske mase
- 5.2 Ciklus ugljika i vijek trajanja
- 5,3 13C NMR spektroskopija
- 6 Reference
Karakteristike ugljikovog atoma
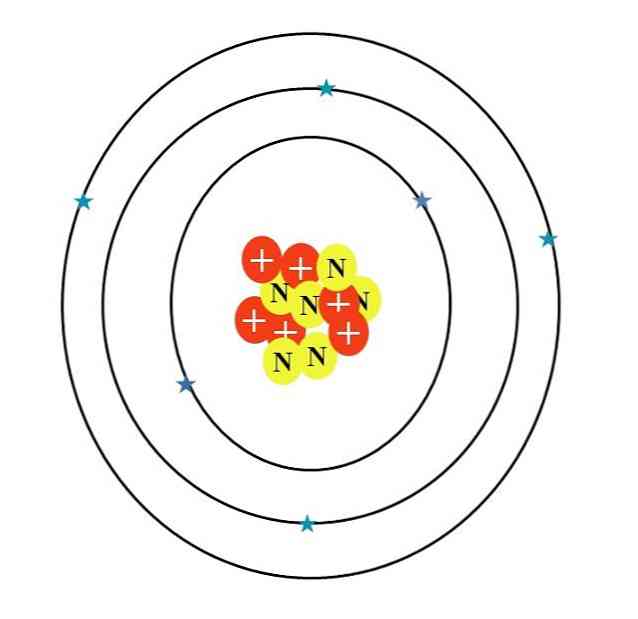
Ugljikov atom je simboliziran slovom C. Njegov atomski broj Z je 6, dakle ima šest protona (crveni krugovi sa simbolom "+" u jezgri). Osim toga, ima šest neutrona (žuti krugovi sa slovom "N") i konačno šest elektrona (plave zvijezde).
Zbroj masa njihovih atomskih čestica daje prosječnu vrijednost od 12,0107 u. Međutim, atom na slici odgovara 12-ugljičnom izotopu (12C), koji se sastoji od d. Ostali izotopi, kao što su 13C i 14C, manje obilan, varira samo u broju neutrona.
Dakle, ako nacrtate ove izotope 13C bi imao dodatni žuti krug, i 14C, još dva. To logično znači da su teži ugljikovi atomi.
Osim toga, koje se druge karakteristike mogu spomenuti u tom pogledu? To je tetravalentno, to jest, može tvoriti četiri kovalentne veze. Nalazi se u skupini 14 (PDV) periodnog sustava, točnije u bloku p.
Također je vrlo svestran atom, sposoban povezati se s gotovo svim elementima periodnog sustava; posebice sa samim sobom, tvoreći makromolekule i linearne, razgranate i lamelarne polimere.
struktura
Kakva je struktura ugljikovog atoma? Da biste odgovorili na ovo pitanje, najprije morate otići u svoju elektroničku konfiguraciju: 1s22s22p2 ili [On] 2s22p2.
Dakle, postoje tri orbitale: 1s2, 2s2 i 2p2, svaki s dva elektrona. To se također može vidjeti na slici iznad: tri prstena s dva elektrona (plave zvijezde) svaki (nemojte brkati prstenove po orbitama: oni su orbitalni).
Napominjemo, međutim, da dvije zvijezde imaju tamnije nijanse plave od ostalih četiri. Zašto? Budući da prva dva odgovaraju unutarnjem sloju 1s2 ili [On], koji ne sudjeluje izravno u stvaranju kemijskih veza; dok elektroni u vanjskom sloju, 2s i 2p, rade.
S i p orbitale nemaju isti oblik, tako da prikazani atom nije prema stvarnosti; uz veliku disproporciju udaljenosti između elektrona i jezgre, koja bi trebala biti stotina puta veća.
Stoga se struktura ugljikovog atoma sastoji od tri orbitale u kojima se elektroni "tale" u difuzne elektronske oblake. A između jezgre i tih elektrona postoji udaljenost koja nam omogućuje da vidimo golemu "prazninu" unutar atoma.
hibridizacija
Ranije je spomenuto da je ugljikov atom tetravalentan. Prema svojoj elektronskoj konfiguraciji, njegovi 2s elektroni su upareni i 2p elektroni su nespareni:
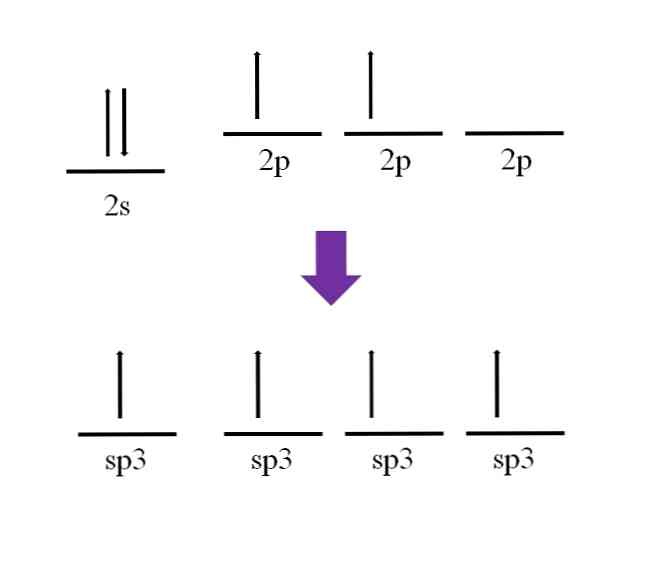
Ostaje raspoloživa p orbital, koja je prazna i ispunjena dodatnim elektronom u atomu dušika (2p3).
Prema definiciji kovalentne veze, nužno je da svaki atom pridonosi elektronu za njegovo formiranje; Međutim, može se primijetiti da je bazalno stanje ugljikovog atoma, jedva da ima dva nesparena elektrona (jedan u svakoj 2p orbitali). To znači da je u tom stanju dvovalentni atom, te stoga formira samo dvije veze (-C-)..
Dakle, kako je moguće da ugljikov atom formira četiri veze? Da biste to učinili, morate promovirati elektron iz orbite 2s u orbitalu 2p više energije. Činjenica je da su četiri rezultirajuće orbitale degenerirati; drugim riječima, imaju istu energiju ili stabilnost (imajte na umu da su usklađeni).
Ovaj proces je poznat kao hibridizacija, i zahvaljujući njemu, sada ugljikov atom ima četiri orbitalne sp3 sa po jednim elektronom koji formira četiri veze. To je zbog njegove karakteristike da je tetravalentna.
sp3
Kada atom ugljika posjeduje sp hibridizaciju3, Usmjerite četiri hibridne orbitale na vrhove tetraedra, koji je njegova elektronička geometrija.
Dakle, možete identificirati ugljikov sp3 jer samo formira četiri jednostavne veze, kao u molekuli metana (CH4). Oko toga se može vidjeti tetraedarska okolina.
Preklapanje sp orbitala3 ona je toliko učinkovita i stabilna da jednostavna C-C veza ima entalpiju od 345,6 kJ / mol. To objašnjava zašto postoje beskrajne strukture ugljika i nemjerljiv broj organskih spojeva. Osim toga, atomi ugljika mogu tvoriti i druge vrste veza.
sp2 i sp
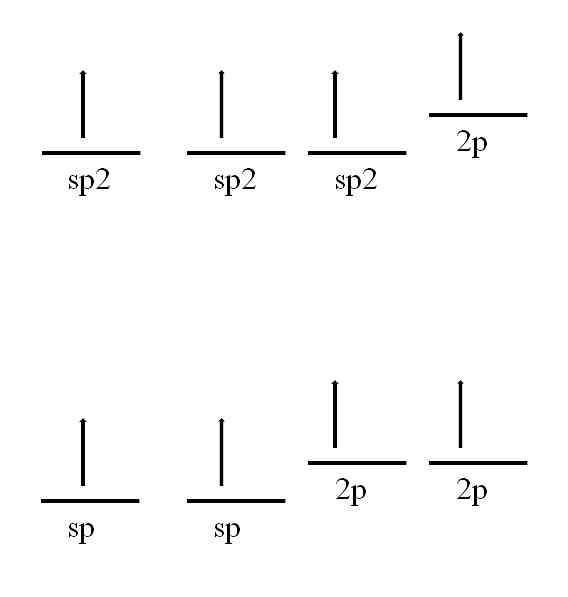
Ugljikov atom je također sposoban usvojiti druge hibridizacije, što će joj omogućiti da formira dvostruku ili čak trostruku vezu.
U hibridizaciji sp2, Kao što se vidi na slici, postoje tri sp orbitale2 degenerirana i 2p orbitala ostaje nepromijenjena ili "čista". S tri sp orbitale2 razdvojeni 120 °, ugljik tvori tri kovalentne veze crtanjem elektronske geometrije trigonske ravnine; dok s 2p orbitalom, okomitom na ostala tri, ona formira vezu π: -C = C-.
Za slučaj hibridizacije sp postoje dvije sp orbitale razdvojene 180º, tako da crtaju linearnu elektroničku geometriju. Ovaj put, oni imaju dvije čiste 2p orbitale, okomite jedna na drugu, koje omogućuju da ugljik tvori trostruke veze ili dvije dvostruke veze: -C-C- ili ·· C = C = C ·· (središnji ugljik ima sp hibridizaciju) ).
Imajte na umu da ćete uvijek (obično) ako dodate veze oko ugljika, uočiti da je broj jednak četiri. Ova informacija je bitna za crtanje Lewisovih struktura ili molekularnih struktura. Ugljikov atom koji formira pet veza (= C≡C) teoretski je i eksperimentalno nedopustiv.
klasifikacija
Kako su ugljikovi atomi klasificirani? Više od klasifikacije unutarnjim karakteristikama, ona u stvarnosti ovisi o molekularnom okruženju. To znači da se unutar molekule njegovi atomi ugljika mogu klasificirati prema sljedećem.
osnovni
Primarni ugljik je onaj koji je povezan samo s drugim ugljikom. Na primjer, molekula etana, CH3-CH3 sastoji se od dva vezana primarna ugljika. To signalizira kraj ili početak lanca ugljika.
sporedan
Ona je povezana s dva ugljika. Dakle, za molekulu propan, CH3-CH2-CH3, ugljikov atom medija je sekundaran (metilenska skupina, -CH2-).
tercijarni
Tercijarni ugljikovi se razlikuju od ostalih jer se iz njih pojavljuju grane glavnog lanca. Na primjer, 2-metilbutan (koji se također naziva izopentan), CH3-CH(CH3) -CH2-CH3 Ima tercijarni ugljik istaknut masnim slovima.
kvartarni
I konačno, kvartarni ugljikovi, kao što ime implicira, povezani su s četiri druga ugljikova atoma. Molekula neopentana, C(CH3)4 R3 ima kvaterni ugljikov atom.
aplikacije
Jedinica za atomsku masu
Prosječna atomska masa 12C se koristi kao standardna mjera za izračun mase drugih elemenata. Dakle, vodik teži dvanaestinu ovog ugljičnog izotopa, koji se koristi za definiranje onoga što je poznato kao jedinica atomske mase u.
Tako se druge atomske mase mogu usporediti s masom atoma 12C i 1H. Na primjer, magnezij (24Mg) teži otprilike dvostruko više od ugljikovog atoma i 24 puta više od atoma vodika.
Ciklus ugljika i život
Biljke apsorbiraju CO2 u procesu fotosinteze oslobađajući kisik u atmosferu i djelujući kao biljna pluća. Kada umru, postaju drveni ugljen, koji nakon spaljivanja oslobađa CO2. Jedan se dio vraća u biljke, a drugi završava u morskim dnom, hranivši mnoge mikroorganizme.
Kada mikroorganizmi umru, preostala kruta tvar do svojih bioloških sedimenta i nakon milijuna godina pretvara se u ono što je poznato kao ulje.
Kada čovječanstvo koristi ovo ulje kao alternativni izvor energije za spaljivanje ugljena, ono doprinosi oslobađanju više CO2 (i drugi nepoželjni plinovi).
S druge strane, život koristi ugljikove atome iz najdubljih njezinih temelja. To je zbog stabilnosti njegovih veza, što mu omogućuje da formira lance i molekularne strukture koje čine makromolekule jednako važne kao i DNA.
NMR spektroskopija 13C
13C, iako je u mnogo manjem omjeru nego u 12C, njegova brojnost dovoljna je za rasvjetljavanje molekularnih struktura kroz spektroskopiju nuklearne magnetske rezonancije ugljika-13.
Zahvaljujući ovoj analiznoj tehnici, može se odrediti koji atomi okružuju 13C i kojim funkcionalnim skupinama pripadaju. Tako se može odrediti ugljikov skelet bilo kojeg organskog spoja.
reference
- Graham Solomons T.W., Craig B. Fryhle. Organska kemija. Amini. (10. izdanje.) Wiley Plus.
- Blake D. (4. svibnja 2018.). Četiri značajke ugljika. Preuzeto s: sciencing.com
- Kraljevsko kemijsko društvo. (2018.). Carbon. Preuzeto s: rsc.org
- Razumijevanje evolucije. (N. D.). Putovanje ugljikovog atoma. Preuzeto s: evolution.berkeley.edu
- Encyclopædia Britannica. (14. ožujka 2018.) Carbon. Preuzeto s: britannica.com
- Pappas S. (29. rujna 2017.). Činjenice o ugljiku. Preuzeto s: livescience.com


