Struktura, svojstva i uporaba kalcijevog oksida (CaO)
kalcijev oksid (CaO) je anorganski spoj koji sadrži kalcij i kisik u ionskim oblicima (ne treba ga miješati s kalcijevim peroksidom, CaO)2). U svijetu je poznat kao vapno, riječ koja označava bilo koji anorganski spoj koji sadrži karbonate, kalcijeve okside i hidrokside, kao i druge metale kao što su silicij, aluminij i željezo..
Ovaj oksid (ili vapno) također se kolokvijalno navodi kao vapno ili gašeno vapno, ovisno o tome je li hidratiziran ili ne. Lime je kalcijev oksid, dok je gašeno vapno njegov hidroksid. S druge strane, vapnenac (vapnenac ili kaljeni vapno) zapravo je sedimentna stijena koja se sastoji uglavnom od kalcijevog karbonata (CaCO)3).

Jedan je od najvećih prirodnih izvora kalcija i predstavlja sirovinu za proizvodnju kalcijevog oksida. Kako se proizvodi ovaj oksid? Karbonati su podložni toplinskoj razgradnji; zagrijavanje kalcijevih karbonata na temperaturama iznad 825 ° C, što dovodi do stvaranja vapna i ugljičnog dioksida.
Gore navedena tvrdnja može se opisati na sljedeći način: CaCO3(s) → CaO (s) + CO2(G). Budući da je zemljina kora bogata vapnencem i kalcitom, au oceanima i plažama obiluju školjkama (sirovine za proizvodnju kalcijevog oksida), kalcijev oksid je relativno jeftin reagens.
indeks
- 1 Formula
- 2 Struktura
- 3 Svojstva
- 3.1 Topljivost
- 4 Upotreba
- 4.1 Kao mort
- 4.2 U proizvodnji čaša
- 4.3 U rudarstvu
- 4.4 Kao silikatni odstranjivač
- 5 Nanočestice kalcijevog oksida
- 6 Reference
formula
Kemijska formula kalcijevog oksida je CaO, u kojoj je kalcij poput kiselinskog iona (akceptor elektrona) Ca2+, i kisik kao bazični ion (donor elektrona) OR2--.
Zašto kalcij ima +2 naboja? Budući da kalcij spada u skupinu 2 periodnog sustava (g. Becambara), a na raspolaganju su samo dva valentna elektrona za formiranje veza, što daje kisikov atom.
struktura
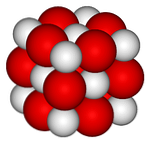
U gornjoj slici prikazana je kristalna struktura (tip gem-soli) za kalcijev oksid. Voluminozne crvene kugle odgovaraju Ca ionima2+ i bijele sfere na ione O2-.
U ovom kubičnom rasporedu kristala svaki ion Ca2+ je okružen sa šest iona O2-, začepljen u oktaedarskim rupama koje su ostavile velike ione između njih.
Ova struktura maksimalno izražava ionski karakter ovog oksida, iako značajna razlika radijusa (crvena kugla veća od bijele) daje slabiju kristalnu retikularnu energiju u usporedbi s MgO.
nekretnine
Fizički, to je kristalna bijela krutina, bez mirisa i jakih elektrostatskih interakcija, koje su odgovorne za visoke točke taljenja (2572 ° C) i vrenje (2850 ° C). Osim toga, ima molekulsku masu od 55,958 g / mol i zanimljivo svojstvo da je termoluminiscentno.
To znači da komad kalcijevog oksida koji je izložen plamenu može sjati intenzivnim bijelim svjetlom, poznatim na engleskom jeziku s imenom centar pažnje, ili na španjolskom, svjetlo kalcija. Ioni Ca2+, u kontaktu s vatrom uzrokuju crvenkasti plamen, kao što je prikazano na sljedećoj slici.

topljivost
CaO je bazični oksid koji ima snažan afinitet prema vodi, u mjeri u kojoj apsorbira vlagu (ona je higroskopna krutina), reagirajući odmah da bi proizveo gašeni vapno ili kalcijev hidroksid:
CaO (s) + H2O (l) => Ca (OH)2(S)
Ova reakcija je egzotermna (oslobađa toplinu) zbog stvaranja krutine s jačim interakcijama i stabilnije kristalne rešetke. Međutim, reakcija je reverzibilna ako se Ca (OH) zagrije2, dehidriranjem i paljenjem gašenog vapna; onda, limeta "se ponovno rađa".
Dobivena otopina je vrlo bazična, a ako je zasićena kalcijevim oksidom doseže pH od 12,8.
Isto tako, topiv je u glicerolu iu kiselim i šećernim otopinama. Budući da se radi o bazičnom oksidu, on prirodno djeluje učinkovito s kiselim oksidima (SiO2, do2O3 i vjere2O3, na primjer) topljiv u tekućim fazama. S druge strane, on je netopljiv u alkoholima i organskim otapalima.
aplikacije
CaO ima veliki broj industrijskih namjena, kao i sintezu acetilena (CH≡CH), u ekstrakciji fosfata iz otpadnih voda iu reakciji sa sumpornim dioksidom iz plinovitog otpada..
Druge uporabe kalcijevog oksida opisane su u nastavku:
Kao žbuka
Ako se kalcijev oksid miješa s pijeskom (SiO2) i vodu, torte s pijeskom i polagano reagira s vodom kako bi se stvorio gašeni vapno. Zauzvrat, CO2 zraka se otapa u vodi i reagira sa solju kako bi nastao kalcijev karbonat:
Ca (OH)2(s) + CO2(g) => CaCO3(s) + H2O (l)
CaCO3 To je otporniji i tvrđi spoj od CaO, zbog čega mort (prethodna smjesa) stvrdnjava i fiksira cigle, blokove ili keramiku između njih ili na željenu površinu..
U proizvodnji čaša
Osnovna sirovina za proizvodnju naočala su silicijevi oksidi, koji se miješaju s vapnom, natrijevim karbonatom (Na2CO3) i druge aditive, da bi se zatim podvrgli zagrijavanju, što je rezultiralo staklastom krutinom. Ova kruta tvar se zatim zagrijava i upuhuje u bilo kojoj slici.
U rudarstvu
Gašeno vapno zauzima veći volumen od vapna zbog interakcija vodikovih veza (O-H-O). Ovo svojstvo se koristi za razbijanje stijena iznutra.
To se postiže punjenjem kompaktnom mješavinom vapna i vode, koja se zapečati kako bi usmjerila svoju toplinu i ekspanzivnu snagu u stijeni..
Kao silikatni odstranjivač
CaO je spojen sa silikatima kako bi se stvorila koalescentna tekućina, koja se zatim ekstrahira iz sirovine određenog proizvoda..
Na primjer, željezne rude su sirovina za proizvodnju metalnog željeza i čelika. Ti minerali sadrže silikate, koji su nepoželjne nečistoće u procesu i eliminiraju se upravo opisanom metodom.
Nanočestice kalcijevog oksida
Kalcijev oksid se može sintetizirati kao nanočestice, mijenjajući koncentracije kalcijevog nitrata (Ca (NO3)2) i natrijev hidroksid (NaOH) u otopini.
Te su čestice sferične, osnovne (kao i čvrste makrorazine) i imaju veliku površinu. Posljedično, ta svojstva pridonose katalitičkim procesima. Što je? Istraga trenutno odgovara na to pitanje.
Ove nanočestice su korištene za sintezu supstituiranih organskih spojeva - izvedenih iz piridina - u formulaciji novih lijekova za provođenje kemijskih transformacija kao što su umjetna fotosinteza, za pročišćavanje vode od teških i štetnih metala, te fotokatalitička sredstva.
Nanočestice se mogu sintetizirati na biološkoj podlozi, kao što su listovi papaje i zelenog čaja, kako bi se koristili kao antibakterijsko sredstvo..
reference
- scifun.org. (2018.). Vapno: kalcijev oksid. Preuzeto 30. ožujka 2018. s: scifun.org.
- Wikipedia. (2018.). Kalcijev oksid. Preuzeto 30. ožujka 2018. s adrese: en.wikipedia.org
- Ashwini Anantharaman et al. (2016). Zelena sinteza nanočestica kalcijevog oksida i njezine primjene. Int. Journal of Engineering Research and Application. ISSN: 2248-9622, svezak 6, izdanje 10, (dio -1), str. 27-31.
- J. Safaei-Ghomi et al. (2013). Nanočestice kalcijevog oksida katalizirane u jednom koraku višekomponentna sinteza visoko supstituiranih piridina u vodenoj etanolnoj sredini Scientia Iranica, Transakcije C: Kemija i kemijsko inženjerstvo 20 549-554.
- Pubchem. (2018.). Kalcijev oksid. Preuzeto 30. ožujka 2018., iz: pubchem.ncbi.nlm.nih.gov
- Shiver & Atkins. (2008). Anorganska kemija u Elementi skupine 2. (četvrto izdanje, str. 280). Mc Graw Hill.


