Područje studija i primjena kemije okoliša
kemija okoliša Proučava kemijske procese koji se odvijaju na razini okoliša. To je znanost koja primjenjuje kemijske principe na proučavanje učinka na okoliš i utjecaje koji proizlaze iz ljudskih aktivnosti.
Osim toga, okolišna kemija dizajnira tehnike prevencije, ublažavanja i sanacije postojećih šteta u okolišu.
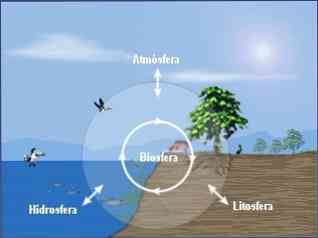
Kemija okoliša može se podijeliti u tri osnovne discipline:
- Kemija okoliša u atmosferi.
- Kemija okoliša hidrosfere.
- Okolišna kemija tla.
Sveobuhvatni pristup kemiji okoliša također zahtijeva proučavanje međuodnosa između kemijskih procesa koji se javljaju u ta tri odjeljka (atmosfera, hidrosfera, tlo) i njihovi odnosi s biosferom..
indeks
- 1 Kemija okoliša u atmosferi
- 1.1 - Stratosfera
- 1.2 -Tropposfera
- 2 Kemija okoliša hidrosfere
- 2.1 - Svježa voda
- 2.2 - Ciklus vode
- 2.3 - Antropološki utjecaji na vodeni ciklus
- 3 Okolišna kemija tla
- 3.1 Tlo
- 3.2 Antropološki utjecaji na tlo
- 4 Kemijsko-okolišni odnos
- 4.1 -Model Garrels i Lerman
- 5 Primjena kemije okoliša
- 6 Reference
Kemija okoliša u atmosferi
Atmosfera je sloj plinova koji okružuju Zemlju; to je vrlo složen sustav, gdje se temperatura, tlak i kemijski sastav mijenjaju s visinom u vrlo širokom rasponu.
Sunce bombardira atmosferu zračenjem i česticama visoke energije; ta činjenica ima vrlo značajne kemijske učinke u svim slojevima atmosfere, ali posebno u najvišim i vanjskim slojevima.
-stratosfera
Reakcije fotodisociacije i fotoionizacije javljaju se u vanjskim dijelovima atmosfere. U području između 30 i 90 km visine mjereno od zemljine površine, u stratosferi se nalazi sloj koji sadrži uglavnom ozon (OR)3), nazvan ozonski omotač.
Ozonski sloj
Ozon upija visokoenergetsko ultraljubičasto zračenje koje dolazi od sunca, a ako ne i za postojanje ovog sloja, nema poznatog načina života na planeti, može opstati.
Godine 1995. kemičari atmosfere Mario J. Molina (meksički), Frank S. Rowland (Amerikanac) i Paul Crutzen (Nizozemac), osvojili su Nobelovu nagradu za kemiju za svoja istraživanja o uništavanju i osiromašenju ozona u stratosferi.
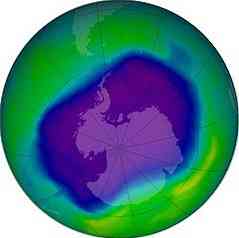
Godine 1970. Crutzen je pokazao da dušikovi oksidi uništavaju ozon katalitičkim kemijskim reakcijama. Potom su Molina i Rowland 1974. godine pokazali da je klor spojeva klorofluorougljika (CFC) također sposoban uništiti ozonski omotač..
-troposfera
Atmosferski sloj neposredno iznad zemljine površine, visok između 0 i 12 km, nazvan troposfera, sastoji se uglavnom od dušika (N2i kisik (O2).
Otrovni plinovi
Kao rezultat ljudskih aktivnosti, troposfera sadrži mnoge dodatne kemikalije koje se smatraju zagađivačima zraka, kao što su:
- Dioksid i ugljični monoksid (CO2 i CO).
- Metan (CH4).
- Dušikov oksid (NO).
- Sumpor dioksid (SO)2).
- Ozon O3 (smatra se kontaminantom u troposferi)
- Hlapljivi organski spojevi (VOC), prašci ili krute čestice.
Među mnogim drugim tvarima koje utječu na zdravlje ljudi i biljke i životinje.
Kisele kiše
Oksidi sumpora (SO2 i SO3i dušikovih, kao što je dušikov oksid (NO2), uzrokovati još jedan ekološki problem koji se naziva kisela kiša.
Ovi oksidi, prisutni u troposferi uglavnom kao produkti izgaranja fosilnih goriva u industrijskim aktivnostima i transportu, reagiraju s kišnicom koja proizvodi sumpornu kiselinu i dušičnu kiselinu, s tim što dolazi do kiselih oborina.
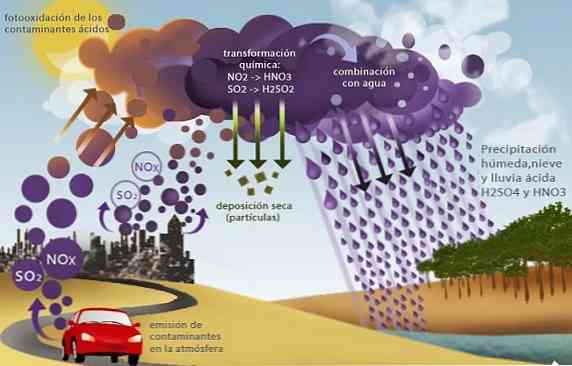
Precipitirajući ovu kišu koja sadrži jake kiseline, ona pokreće nekoliko ekoloških problema, kao što je zakiseljavanje mora i slatkih voda. To uzrokuje smrt vodenih organizama; zakiseljavanje tla koje uzrokuje smrt usjeva i uništavanje kemijskim korozivnim djelovanjem zgrada, mostova i spomenika.
Drugi problemi u atmosferi su fotokemijski smog uzrokovan uglavnom dušikovim oksidima i troposferskim ozonom
Globalno zatopljenje
Globalno zagrijavanje nastaje zbog visokih koncentracija CO2 atmosferski i drugi staklenički plinovi (GHG), koji apsorbiraju veći dio infracrvenog zračenja koje emitira Zemljina površina i zadržavaju toplinu u troposferi. To stvara klimatske promjene na planetu.
Kemija okoliša hidrosfere
Hidrosfera je usklađena sa svim vodenim tijelima Zemlje: površinskim ili humedalima - oceane, jezera, rijeke, izvori - i podzemni ili vodonosnici.
-Slatka voda
Voda je najčešća tekuća tvar na planeti, pokriva 75% površine Zemlje i apsolutno je neophodna za život.
Svi oblici života ovise o slatkoj vodi (definirana kao voda sa sadržajem soli manjim od 0,01%). 97% vode planete je slane vode.
Od preostalih 3% slatke vode, 87% je u:
- Polovi Zemlje (koji se zbog globalnog zagrijavanja topi i ulivaju u mora).
- Ledenjaci (također u procesu nestajanja).
- Podzemne vode.
- Voda u obliku pare prisutna u atmosferi.
Samo 0,4% ukupne slatke vode planeta je dostupno za potrošnju. Isparavanje vode iz oceana i oborina kiše stalno osiguravaju taj mali postotak.
Kemija okoline vode proučava kemijske procese koji se odvijaju u ciklusu vode ili hidrološkom ciklusu te razvija tehnologije za pročišćavanje vode za ljudsku potrošnju, obradu industrijskih i gradskih otpadnih voda, desalinizaciju morske vode, recikliranje i spremanje tog resursa, između ostalog.
-Ciklus vode
Ciklus vode na Zemlji sastoji se od tri glavna procesa: isparavanja, kondenzacije i oborina, od kojih su izvedena tri kruga:
- Površinsko otjecanje
- Evapotranspiracija biljaka
- Infiltracija, u kojoj voda prelazi u podzemne razine (podzemne vode), cirkulira kroz kanale vodonosnika i izlazi kroz izvore, izvore ili izvore.
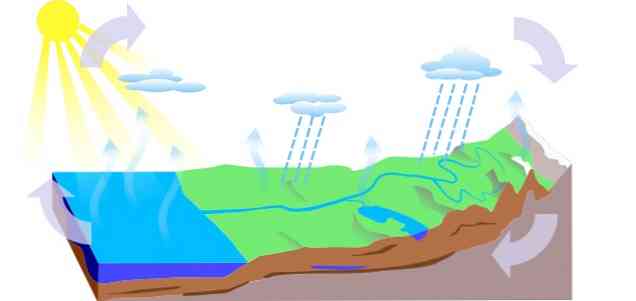
-Antropološki utjecaji na vodeni ciklus
Ljudska aktivnost utječe na ciklus vode; Neki od uzroka i posljedica antropološkog djelovanja su sljedeći:
Modifikacija površine zemljišta
Nastaje uništavanjem šuma i polja krčenjem šuma. To utječe na ciklus vode uklanjanjem evapotranspiracije (uzimanje vode kroz biljke i povratak u okoliš putem transpiracije i isparavanja) i povećavanje otjecanja.
Povećano površinsko otjecanje uzrokuje povećani protok rijeka i poplave.
Urbanizacija također modificira površinu kopna i utječe na vodeni ciklus, budući da je porozno tlo zamijenjeno cementom i nepropusnim asfaltom, što onemogućava infiltraciju..
Kontaminacija ciklusa vode
Ciklus vode uključuje cjelokupnu biosferu i posljedično, otpad koji stvara ljudsko biće inkorporiran je u ovaj ciklus različitim procesima.
Kemijski zagađivači u zraku ugrađuju se u kišu. Agrokemikalije primijenjene na tlo, propuštaju procjedne vode i infiltriraju se u vodonosnike ili bježe u rijeke, jezera i mora.
Također se odlaganje masti i ulja i procjednih voda odlagališta odvlače infiltracijom u podzemne vode.
Vađenje vodnih zaliha uz prekoračenje u vodnim resursima
Ove prakse s prekoračenjem, proizvode iscrpljivanje zaliha podzemnih i površinskih voda, utječu na ekosustave i proizvode lokalno slijeganje tla.
Okolišna kemija tla
Tla su jedan od najvažnijih čimbenika u ravnoteži biosfere. Oni osiguravaju sidrenje, vodu i hranjive tvari biljkama koje su proizvođači u zemaljskim trofičkim lancima.
Pod
Tlo se može definirati kao složen i dinamičan ekosustav tri faze: čvrsta faza mineralne i organske potpore, vodena tekuća faza i plinska faza; koje karakterizira određena fauna i flora (bakterije, gljivice, virusi, biljke, insekti, nematode, protozoe).
Svojstva tla se stalno mijenjaju zbog ekoloških uvjeta i biološke aktivnosti koja se u njoj razvija..
Antropološki utjecaji na tlo
Degradacija tla je proces koji smanjuje proizvodni kapacitet tla, sposoban proizvesti duboku i negativnu promjenu u ekosustavu.
Čimbenici koji uzrokuju degradaciju tla su: klima, fiziografija, litologija, vegetacija i ljudsko djelovanje.

Ljudskim djelovanjem može se dogoditi:
- Fizička degradacija tla (na primjer, zbijanje zbog neodgovarajućeg uzgoja i prakse uzgoja).
- Kemijska degradacija tla (zakiseljavanje, alkaliziranje, salinizacija, kontaminacija agrokemikalijama, otpadnim vodama industrijske i urbane djelatnosti, izlijevanje nafte, između ostalog).
- Biološka degradacija tla (smanjenje sadržaja organske tvari, degradacija vegetacijskog pokrivača, gubitak mikroorganizama koji fiksiraju dušik, između ostalog).
Kemijsko-okolišni odnos
Kemija okoliša proučava različite kemijske procese koji se odvijaju u tri dijela okoliša: atmosferi, hidrosferi i tlu. Zanimljivo je preispitati dodatni naglasak na jednostavnom kemijskom modelu, koji pokušava objasniti globalne transfere materije koja se javlja u okolišu.
-Model Garrels i Lerman
Garrels i Lerman (1981.) razvili su pojednostavljeni model biogeokemije Zemljine površine, koji proučava interakcije između atmosfere, hidrosfere, zemljine kore i biosfernih komora..
Model Garrelsa i Lermana razmatra sedam glavnih sastojaka planeta:
- Žbuka (CaSO4)
- Pirit (FeS2)
- Kalcijev karbonat (CaCO3)
- Magnezijev karbonat (MgCO3)
- Magnezijev silikat (MgSiO3)
- Željezni oksid (Fe2O3)
- Silicijev dioksid (SiO)2)
Organska tvar koja čini biosferu (živu i mrtvu), predstavljena je kao CH2Ili, što je približni stehiometrijski sastav živih tkiva.
U Garrelsovom i Lermanovu modelu, geološke promjene su proučavane kao neto prijenosi tvari između ovih osam komponenti planeta, kroz kemijske reakcije i ravnotežu neto očuvanja mase..
Akumulacija CO2 u atmosferi
Na primjer, problem nakupljanja CO2 u atmosferi proučava se u ovom modelu, govoreći da: trenutno spaljujemo organski ugljik pohranjen u biosferi kao ugljen, naftu i prirodni plin pohranjeni u podzemlju u prošlim geološkim vremenima.
Kao rezultat ovog intenzivnog sagorijevanja fosilnih goriva, koncentracija CO2 atmosferski raste.
Povećanje koncentracije CO2 u zemaljskoj atmosferi to je zato što brzina izgaranja fosilnog ugljika premašuje stopu apsorpcije ugljika od drugih komponenti Zemljinog biogeokemijskog sustava (kao što su fotosintetski organizmi i hidrosfera, na primjer).
Na taj način emisija CO2 u atmosferu zbog ljudskih aktivnosti, nadilazi regulatorni sustav koji modulira promjene na Zemlji.
Veličina biosfere
Model koji su razvili Garrels i Lerman također smatra da se veličina biosfere povećava i smanjuje kao rezultat ravnoteže između fotosinteze i disanja.
Tijekom povijesti života na Zemlji, masa biosfere se povećavala u fazama s visokim stopama fotosinteze. To je rezultiralo neto skladištenjem emisije organskog ugljika i kisika:
CO2 + H2O → CH2O + O2
Disanje kao metabolička aktivnost mikroorganizama i viših životinja, pretvara organski ugljik natrag u ugljični dioksid (CO2i vode (H2O), to jest, obrće prethodnu kemijsku reakciju.
Prisutnost vode, skladištenje organskog ugljika i proizvodnja molekularnog kisika su temelj za postojanje života.
Primjena kemije okoliša
Kemija okoliša nudi rješenja za prevenciju, ublažavanje i sanaciju šteta u okolišu uzrokovanih ljudskim aktivnostima. Među nekim od tih rješenja možemo spomenuti:
- Dizajn novih materijala pod nazivom MOF (za akronim na engleskom jeziku: Metalni organski okviri). Oni su vrlo porozni i imaju sposobnost: apsorbirati i zadržati CO2, dobiti H2Ili isparavanje zraka iz pustinjskih područja i pohranjivanje H2 u malim spremnicima.
- Pretvorba otpada u sirovine. Primjerice, korištenje istrošenih guma u proizvodnji umjetnih trava ili potplata cipela. Također, upotreba otpada za obrezivanje usjeva, u proizvodnji bioplina ili bioetanola.
- Kemijska sinteza zamjena za CFC.
- Razvoj alternativnih energija, kao što su vodikove stanice, za proizvodnju čiste električne energije.
- Kontrola atmosferskog onečišćenja, s inertnim filtrima i reaktivnim filtrima.
- Desalinizacija morske vode reverznom osmozom.
- Razvoj novih materijala za flokulaciju koloidnih tvari suspendiranih u vodi (proces pročišćavanja).
- Povratak eutrofikacije jezera.
- Razvoj "zelene kemije", trend koji predlaže zamjenu otrovnih kemijskih spojeva s manje toksičnim, i "ekološki prihvatljive" kemijske postupke. Primjerice, primjenjuje se u korištenju manje toksičnih otapala i sirovina, u industriji, u kemijskom čišćenju praonica, među ostalima..
reference
- Calvert, J.G., Lazrus, A., Kok, G.L., Heikes, B.G., Walega, J.G., Lind, J., i Cantrell, C.A. (1985). Kemijski mehanizmi stvaranja kiselina u troposferi. Nature, 317 (6032), 27-35. doi: 10.1038 / 317027a0.
- Crutzen, P.J. (1970). Utjecaj dušikovih oksida na atmosferski sadržaj. Q.J.R. Metheorol. Soc. Wiley-Blackwell. 96: 320-325.
- Garrels, R.M. i Lerman, A. (1981). Fanerozoički ciklusi sedimentnog ugljika i sumpora. Zbornik radova Prirodne akademije znanosti. USA 78: 4,652-4,656.
- Hester, R.E. i Harrison, R.M. (2002). Globalna promjena okoliša. Kraljevsko kemijsko društvo. 205.
- Hites, R.A. (2007). Elementi kemije okoliša. Wiley Interscience. 215.
- Manahan, S.E. (2000). Kemija okoliša. Sedmo izdanje. CRC. str. 876
- Molina, M.J. i Rowland, F.S. (1974). Stratosferski sudoper za klorofluorometane: klorirano katalizirano uništavanje ozona. Priroda. 249: 810-812.
- Morel, F.M. i Hering, J.M. (2000). Principi i primjena vodene kemije. New York: John Wiley.
- Stockwell, W.R., Lawson, C.V., Saunders, E., i Goliff, W.S. (2011). Pregled troposferske atmosferske kemije i kemijskih mehanizama plinske faze za modeliranje kvalitete zraka. Atmosfera, 3 (1), 1-32. doi: 10.3390 / atmos3010001


