Balansiranje kemijskih jednadžbi Metode i primjeri
balansiranje kemijskih jednadžbi podrazumijeva da svi elementi prisutni u navedenoj jednadžbi imaju isti broj atoma na svakoj strani. Da bi se to postiglo potrebno je upotrijebiti metode uravnoteženja za dodjeljivanje stehiometrijskih koeficijenata prikladnih za svaku vrstu prisutnu u reakciji.
Kemijska jednadžba je prikaz, pomoću simbola, onoga što se događa tijekom kemijske reakcije između dvije ili više tvari. Reaktanti međusobno djeluju i, ovisno o reakcijskim uvjetima, dobiva se jedan ili više različitih spojeva kao produkt..
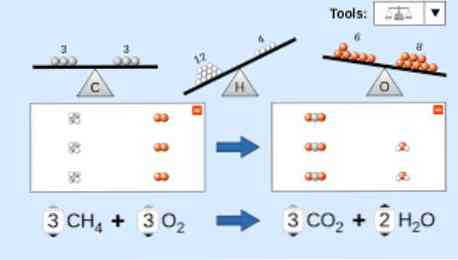
Prilikom opisivanja kemijske jednadžbe treba uzeti u obzir sljedeće: Prvo, reaktantne tvari se ispisuju na lijevoj strani jednadžbe, a zatim slijedi jednosmjerna strelica ili dvije suprotne horizontalne strelice, ovisno o vrsti reakcije koja se izvodi. rt.
indeks
- 1 Metode uravnoteženja kemijskih jednadžbi
- 1.1 Ravnoteža kemijskih jednadžbi metodom pokušaja i pogreške (također nazvana inspekcijom ili ispitivanjem)
- 1.2 Algebarsko uravnoteženje kemijskih jednadžbi
- 1.3 Uvrtanje redoks jednadžbi (ion-elektron metoda)
- 2 Primjeri uravnoteženja kemijskih jednadžbi
- 2.1 Prvi primjer
- 2.2 Drugi primjer
- 2.3 Treći primjer
- 3 Reference
Metode uravnoteženja kemijskih jednadžbi
Uzimajući kao osnovu da su reaktanti i proizvodi poznati, te da su njihove formule ispravno izražene na strani koja im odgovara, nastavljamo ravnotežu jednadžbi prema sljedećim metodama..
Uravnoteženje kemijskih jednadžbi metodom pokušaja i pogreške (također nazvano ispitivanjem ili ispitivanjem)
Temelji se na stehiometriji reakcije i pokušava pokušati s različitim koeficijentima kako bi se uravnotežila jednadžba, sve dok se biraju najmanji mogući cjeloviti brojevi s kojima se dobiva isti broj atoma svakog elementa na obje strane. reakcije.
Koeficijent reaktanta ili proizvoda je broj koji prethodi njegovoj formuli, i to je jedini broj koji se može promijeniti prilikom uravnoteženja jednadžbe, budući da bi promjena indeksa formula promijenila identitet spoja. u pitanju.
Brojite i usporedite
Nakon što smo identificirali svaki element reakcije i stavili ga na ispravnu stranu, nastavljamo brojati i uspoređivati broj atoma svakog elementa prisutnog u jednadžbi i odrediti one koji moraju biti uravnoteženi.
Zatim nastavljamo s balansiranjem svakog elementa (jedan po jedan) stavljanjem cijelih koeficijenata ispred svake formule koja sadrži neuravnotežene elemente. Obično su metalni elementi najprije uravnoteženi, zatim nemetalni elementi i na kraju atomi kisika i vodika.
Na taj način svaki koeficijent množi sve atome prethodne formule; tako da dok balansiranje elementa drugi mogu debalansirati, ali to je ispravljeno kako je reakcija uravnotežena.
Konačno, potkrjepljen je posljednjim brojem da je cijela jednadžba ispravno uravnotežena, odnosno da se pridržava zakona očuvanja materije.
Algebarsko uravnoteženje kemijskih jednadžbi
Da bi se koristila ova metoda, uspostavljen je postupak za tretiranje koeficijenata kemijskih jednadžbi kao nepoznanica sustava koji se mora riješiti..
Prvo, određeni element reakcije uzima se kao referenca, a koeficijenti se postavljaju kao slova (a, b, c, d ...), koji predstavljaju nepoznanice, prema postojećim atomima tog elementa u svakoj molekuli (ako vrsta ne sadrži taj element koji se nalazi "0").
Nakon dobivanja ove prve jednadžbe, određuju se jednadžbe za ostale elemente prisutne u reakciji; bit će onoliko jednadžbi koliko ima elemenata u navedenoj reakciji.
Konačno, nepoznanice se određuju jednom od algebarskih metoda redukcije, izjednačavanja ili zamjene, a koeficijenti se dobivaju koji rezultiraju ispravno uravnoteženom jednadžbom.
Balansiranje redoks jednadžbi (ion-elektron metoda)
Prvo se opća (neuravnotežena) reakcija stavlja u njezin ionski oblik. Tada je ova jednadžba podijeljena u dvije polu-reakcije, oksidaciju i redukciju, pri čemu svaki balansira prema broju atoma, njihovoj vrsti i naboju tih.
Na primjer, za reakcije koje se odvijaju u kiselom mediju dodaju se H molekule.2Ili uravnotežiti atome kisika i dodati H+ za uravnoteženje atoma vodika.
Nasuprot tome, u alkalnom mediju dodan je jednak broj OH iona- na dvije strane jednadžbe za svaki H ion+, i gdje nastaju H ioni+ i OH- oni se udružuju da bi formirali H molekule2O.
Dodajte elektrone
Tada morate dodati onoliko elektrona koliko je potrebno za uravnoteženje naboja, nakon balansiranja materije u svakoj polovici reakcije.
Nakon valjanja svake polu-reakcije, one se dodaju i kulminiraju balansiranjem konačne jednadžbe pokusom i pogreškom. U slučaju razlike u broju elektrona u dvije polu-reakcije, jedan ili oba moraju se pomnožiti s koeficijentom koji je jednak tom broju.
Konačno, mora se potvrditi da jednadžba uključuje isti broj atoma i istog tipa atoma, osim što imaju iste naboje na obje strane globalne jednadžbe..
Primjeri uravnoteženja kemijskih jednadžbi
Prvi primjer
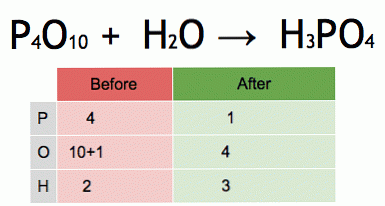
Ovo je animacija uravnotežene kemijske jednadžbe. Fosfor pentoksid i voda pretvaraju se u fosfornu kiselinu.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Drugi primjer
Imate reakciju sagorijevanja etana (neuravnoteženo).
C2H6 + O2 → CO2 + H2O
Koristeći metodu pokušaja i pogreške za uravnoteženje, uočava se da niti jedan od elemenata nema isti broj atoma na obje strane jednadžbe. Dakle, počinje s ravnotežom ugljika, dodajući dva kao stehiometrijski koeficijent koji ga prati na strani proizvoda.
C2H6 + O2 → 2CO2 + H2O
Ugljik je uravnotežen na obje strane, tako da nastavljamo ravnotežu vodika dodavanjem tri u molekulu vode.
C2H6 + O2 → 2CO2 + 3H2O
Konačno, budući da na desnoj strani jednadžbe ima sedam atoma kisika i da je posljednji element još uvijek uravnotežen, frakcijski broj 7/2 nalazi se ispred molekule kisika (iako su općenito preferirani cijeli koeficijenti).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Potom provjerite da na svakoj strani jednadžbe postoji isti broj ugljikovih atoma (2), vodika (6) i kisika (7)..
Treći primjer
Oksidacija željeza dikromatnim ionima odvija se u kiselom mediju (neuravnotežen iu ionskom obliku).
vjera2+ + Cr2O72- → Vjera3+ + Cr3+
Koristeći ion-elektronsku metodu za balansiranje, podijeljena je u dvije polu-reakcije.
Oksidacija: Vjera2+ → Vjera3+
Smanjenje: Cr2O72- → Cr3+
Budući da su atomi željeza već uravnoteženi (1: 1), dodaje se elektron na stranu proizvoda kako bi se uravnotežio naboj.
vjera2+ → Vjera3+ + i-
Sada su atomi Cr uravnoteženi, dodajući dva na desnu stranu jednadžbe. Zatim, kada se reakcija odvija u kiselom mediju, dodaje se sedam H molekula.2Ili na strani proizvoda kako bi se uravnotežili atomi kisika.
Cr2O72- → 2Cr3+ + 7H2O
Da bi se uravnotežili atomi H, dodaju se četrnaest H iona+ na strani reaktanata i, nakon izjednačavanja materijala, naboji su uravnoteženi dodavanjem šest elektrona na istoj strani.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Konačno, dodaju se obje polu-reakcije, ali budući da u reakciji oksidacije postoji samo jedan elektron, sve se to mora pomnožiti sa šest..
6Fe2+ + Cr2O72- +14H+ + 6e- → Vjera3+ + 2-kanalni3+ + 7H2O + 6e-
Konačno, elektroni se moraju eliminirati na obje strane globalne ionske jednadžbe, provjeravajući jesu li njihova naboja i materija pravilno uravnoteženi.
reference
- Chang, R. (2007). Kemija. (9. izdanje). McGraw-Hill.
- Hein, M., i Arena, S. (2010). Temelji fakultetske kemije, alternativni. Preuzeto s books.google.co.ve
- Tuli, G.D. i Soni, P.L. (2016). Jezik kemije ili kemijske jednadžbe. Preuzeto s books.google.co.ve
- Speedy Publishing (2015). Kemijske jednadžbe i odgovori (Speedy Study Guides). Preuzeto s books.google.co.ve


