Butino struktura, svojstva i uporaba
butina je kemijski spoj koji pripada skupini alkina, karakteriziran uglavnom imajući u svojoj strukturi barem trostruku vezu između dva atoma ugljika.
Kada je riječ o utvrđivanju pravila za naziv alkina, IUPAC (akronim na engleskom jeziku za International Union of Pure and Applied Chemistry) je utvrdio da se koriste isti kao i za alkenes.

Temeljna razlika između nomenklature obje vrste tvari je u tome što se sufiks -on mijenja u -ili kada se radi o spojevima koji imaju trostruke veze u svojoj strukturi.
S druge strane, butino se sastoji samo od ugljika i vodika, a dolazi u dva oblika: 1-butin, koji je u plinovitoj fazi pod standardnim uvjetima tlaka i temperature (1 atm, 25 ° C); i 2-butino, koji je vrsta tekuće faze proizvedene kemijskom sintezom.
indeks
- 1 Kemijska struktura
- 1.1 1-butino
- 1.2 2-butin
- 2 Svojstva
- 3 Upotreba
- 4 Reference
Kemijska struktura
U molekuli poznatoj kao butino prikazan je fenomen strukturne izomerizacije položaja, koji se sastoji od prisutnosti istih funkcionalnih skupina u oba spoja, ali svaka od njih je na drugom mjestu lanca.
U ovom slučaju, oba oblika butina imaju identičnu molekulsku formulu; međutim, u 1-butinu trostruka veza se nalazi u ugljiku broj jedan, dok se u 2-butinu nalazi u broju dva. To ih pretvara u izomere položaja.
Zbog položaja trostruke veze u jednom od terminala 1-butin strukture, smatra se terminalnim alkinom, dok međupoložaj trostruke veze u 2-butin strukturi daje klasifikaciju internog alkina..
Dakle, veza može biti samo između prvog i drugog ugljika (1-butin) ili između drugog i trećeg ugljika (2-butin). Razlog tome je primijenjena nomenklatura, gdje će najniža moguća numeracija uvijek biti dodijeljena poziciji trostruke obveznice.
1-butina
Spoj nazvan 1-butin je također poznat kao etil-acetilen zbog svoje strukture i načina na koji su njegova četiri ugljikova atoma raspoređena i vezana. Međutim, kada govorimo o tome butina spominje se samo ova kemijska vrsta.
U ovoj molekuli, trostruka veza se nalazi u terminalnom ugljiku, što omogućuje dostupnost atoma vodika koji mu daju veliku reaktivnost.
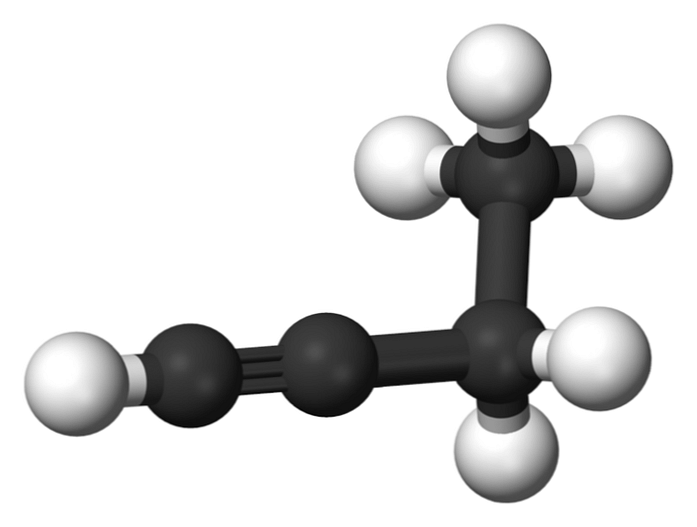
Ta kruta i jača veza od jednostruke ili dvostruke veze između ugljikovih atoma osigurava stabilnu konfiguraciju 1-butin linearne geometrije.
S druge strane, ova plinovita tvar je prilično zapaljiva, tako da u prisutnosti topline može lako izazvati požare ili eksplozije i imati veliku reaktivnost u prisutnosti zraka ili vode..
2-butin
Budući da interni alkini pokazuju veću stabilnost od terminalnih alkina, oni omogućuju transformaciju 1-butina u 2-butin.
Ova izomerizacija može nastati zagrijavanjem 1-butina u prisutnosti baze (kao što je NaOH, KOH, NaOCH3 ...) ili preraspodjelom 1-butina u otopini kalijevog hidroksida (KOH) u etanolu (C).2H6O).
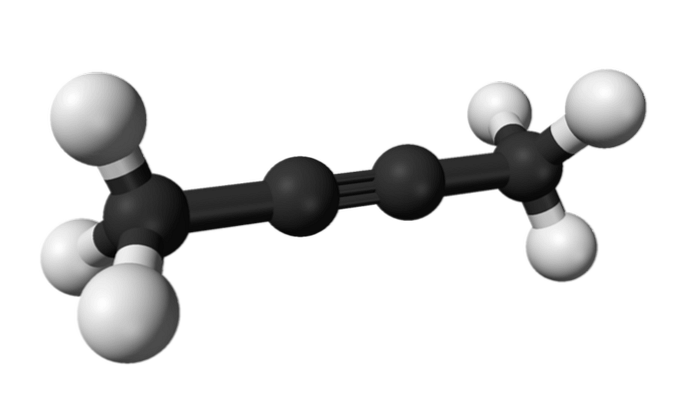
Na isti način, kemikalija poznata kao 2-butin se naziva i dimetilacetilen (ili krotonilen), koja se predstavlja kao tekuća i hlapljiva vrsta koja nastaje umjetno.
U 2-butinu trostruka veza je u sredini molekule, dajući joj veću stabilnost od izomera.
Osim toga, ovaj bezbojni spoj ima manju gustoću od vode iako se smatra netopljivom u njemu i ima visoku zapaljivost.
nekretnine
-Strukturna formula butina (bez obzira na izomer na koji se upućuje) je C4H6, koja ima linearnu strukturu.
-Jedna od kemijskih reakcija koju izaziva butinska molekula je izomerizacija, u kojoj dolazi do preraspodjele i migracije trostruke veze unutar molekule..
-1-Butin je u plinskoj fazi, ima vrlo visoku zapaljivost i veću gustoću od zraka.
-Ova tvar je također prilično reaktivna, te u prisutnosti topline može uzrokovati nasilne eksplozije.
-Osim toga, kada ovaj bezbojni plin doživi nepotpunu reakciju izgaranja može izazvati ugljični monoksid (CO)
-Kada su oba izomera izložena visokim temperaturama, mogu se pojaviti reakcije polimerizacije eksplozivnog tipa.
-2-butin je u tekućoj fazi, iako se također smatra vrlo zapaljivim pod standardnim uvjetima tlaka i temperature.
-Ove tvari mogu doživjeti nasilne reakcije kada su u prisutnosti jakih oksidirajućih tvari.
-Isto tako, egzotermne reakcije s posljedičnim oslobađanjem plinovitog vodika nastaju u prisutnosti reducirajućih vrsta..
-Kada se nađu u kontaktu s određenim katalizatorima (kao što su neke kisele tvari) ili početnim vrstama, mogu se pojaviti egzotermne reakcije polimerizacije.
aplikacije
Budući da imaju neka druga svojstva, oba izomera mogu imati različite primjene i primjene, kao što je prikazano u nastavku:
Prvo, vrlo često jedna od primjena 1-butina je njegova primjena kao međufaza u procesu proizvodnje drugih tvari organske prirode sintetskog podrijetla..
S druge strane, ova kemijska vrsta koristi se u prerađivačkoj industriji gume i derivata; kao npr. kada želite dobiti benzol.
Slično tome, koristi se u procesu proizvodnje raznih plastičnih proizvoda, kao iu proizvodnji mnogih polietilenskih tvari koje se smatraju visokom gustoćom..
Također, 1-butin se često koristi kao komponenta za procese rezanja i zavarivanja nekih legura metala, uključujući čelik (legura željeza i ugljik)..
U drugom smislu, 2-butin izomer se koristi u kombinaciji s drugim alkinom zvanim propin u sintezi nekih tvari poznatih kao alkilirani hidrokinoni, kada se provodi proces ukupne sinteze a-tokoferola (vitamina E)..
reference
- Wikipedia. (N. D.). Butina. Preuzeto s en.wikipedia.org
- Yoder, C.H., Leber P.A. i Thomsen, M.W. (2010). Most prema organskoj kemiji: koncepti i nomenklatura. Preuzeto s books.google.co.ve
- Study.com. (N. D.). Butin: Strukturna formula i izomeri. Dobiven iz studija.
- Pubchem. (N. D.). 1-butina. Preuzeto s pubchem.ncbi.nlm.nih.gov
- Pubchem. (N. D.). 2-butin. Preuzeto s pubchem.ncbi.nlm.nih.gov


