Struktura, sinteza, svojstva i upotreba pikrinske kiseline
picric acid je visoko nitrirani organski kemijski spoj čije je ime IUPAC 2,4,6-trinitrofenol. Njegova molekularna formula je C6H2(NO2)3OH. To je vrlo kiseli fenol, i može se naći kao natrijev, amonijev ili kalijev pikrat; to jest, u svom ionskom obliku C6H2(NO2)3ONA.
To je čvrsto tijelo snažnog okusa gorčine, a odatle potječe njegovo ime, iz grčke riječi 'prikos', što znači gorko. Nalazi se kao vlažni žuti kristali. Njegovo sušenje ili dehidracija je opasno, jer povećava nestabilna svojstva koja ga čine eksplozivnim.
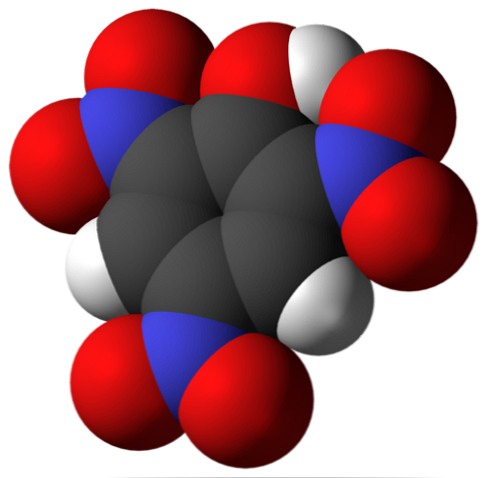
Iznad je molekula pikrinske kiseline. Na slici je teško prepoznati veze i atome jer to odgovara prikazu njegove Van der Waalsove površine. O molekularnoj strukturi detaljnije se govori u sljedećem poglavlju.
Neki intermedijarni spojevi, razne pikratne soli i kompleksi pikrinske kiseline sintetizirani su iz pikrinske kiseline..
Pikrinska kiselina se koristi kao baza za sintezu žutih boja trajnih boja. Neki patolozi i znanstvenici ga koriste u fiksiranju ili bojanju dijelova tkiva i drugih imunohistokemijskih procesa.
Vrlo je koristan u pripremi farmaceutskih proizvoda. Osim toga, koristi se u proizvodnji šibica ili šibica i eksploziva. Također se koristi za graviranje metala, izradu obojenog stakla, te u kolorimetrijskom određivanju bioloških parametara kao što su kreatinin.
S druge strane, pikrinska kiselina iritira kada dođe u kontakt s kožom, s respiratornom, okularnom i probavnom sluznicom. Osim što može ozlijediti kožu, može ozbiljno utjecati na bubrege, krv i jetru, među ostalim organima.
indeks
- 1 Struktura
- 1.1 Kiselinski fenol
- 1.2 Kristalna struktura
- 2 Sažetak
- 2.1 Izravna nitracija fenola
- 3 Fizikalna i kemijska svojstva
- 3.1 Molekularna težina
- 3.2 Fizički izgled
- 3.3 Miris
- 3.4 Okus
- 3.5 Točka taljenja
- 3.6 Vrelište
- 3.7 Gustoća
- 3.8 Topljivost
- 3.9 Korozivnost
- 3,10 pKa
- 3.11 Nestabilnost
- 4 Upotreba
- 4.1 Istraživanje
- 4.2 Organska kemija
- 4.3 U industriji
- 4.4. Vojne primjene
- 5 Toksičnost
- 6 Reference
struktura

Na gornjoj slici, sve veze i sama struktura molekule pikrinske kiseline prikazane su detaljnije. Sastoji se od fenola s tri nitro supstituenta.
Može se vidjeti da u skupinama NO2 dušikov atom ima pozitivan parcijalni naboj i stoga zahtijeva elektronsku gustoću okoline. No, aromatski prsten također privlači elektrone sebi i prije tri NO2 na kraju odustaje od dijela vlastite elektroničke gustoće.
Kao posljedica toga, kisik iz OH skupine ima tendenciju da više dijeli jedan od svojih slobodnih elektronskih parova za opskrbu elektroničkog nedostatka koji trpi prsten; i pri tome se formira veza C = O+-H. Ovo djelomično djelomično opterećenje na kisik slabi O-H vezu i povećava kiselost; to jest, bit će oslobođen kao vodikov ion, H+.
Kiselinski fenol
Zbog toga je ovaj spoj iznimno jaka (i reaktivna) kiselina, čak i više nego sama octena kiselina. Međutim, spoj je zapravo fenol čija kiselost nadmašuje kiselinu drugih fenola; zbog, kao što je upravo spomenuto, NO supstituenata2.
Stoga, kako je fenol, OH skupina ima prioritet i usmjerava popisivanje u strukturi. Tri br2 nalaze se u ugljikovim atomima 2, 4 i 6 aromatskog prstena u odnosu na OH. Stoga IUPAC nomenklatura za ovaj spoj: 2,4,6-trinitrofenol (TNP, za akronim na engleskom).
Ako skupine nisu2, ili ako postoji manji broj njih u prstenu, O-H veza će manje oslabiti, i stoga bi spoj imao nižu kiselost.
Kristalna struktura
Molekule pikrinske kiseline raspoređene su na takav način da pogoduju njihovim intermolekularnim interakcijama; ili za formiranje vodikovih mostova između OH i NO skupina2, dipol-dipolske sile, ili elektrostatičke odbojnosti između deficijentnih područja elektrona.
Može se očekivati da skupine NE2 međusobno su odbijali i bili orijentirani prema susjednim aromatičnim prstenovima. Također, prstenovi se ne mogu poravnati jedan na drugi povećanjem elektrostatskog odbijanja.
Proizvod svih tih interakcija, pikrinska kiselina uspijeva formirati trodimenzionalnu mrežu koja definira kristal; čija jedinična ćelija odgovara kristalnom sustavu ortorombskog tipa.
sinteza
U početku je sintetiziran iz prirodnih spojeva kao što su derivati životinjskog roga, prirodne smole, među ostalima. Od 1841. fenol se koristi kao prekursor pikrinske kiseline, slijedeći nekoliko putova ili kroz različite kemijske postupke.
Kao što je već rečeno, to je jedan od najpoželjnijih kiselih fenola. Da bi se sintetizirala, prvo je potrebno da se fenol podvrgne procesu sulfonacije, nakon čega slijedi postupak nitriranja.
Sulfoniranje bezvodnog fenola provodi se obradom fenola dimom sumpornom kiselinom, s aromatskim elektrofilnim supstitucijama H sulfonatnim skupinama, SO3H, u -ortnom položaju i -za OH skupinu.
Ovom proizvodu, 2,4-fenoldisulfonska kiselina, provodi se proces nitriranja, obradom koncentriranom dušičnom kiselinom. Na taj način, dvije SO skupine3H su zamijenjeni s nitro skupinama, NO2, a treći ulazi u drugi nitro položaj. Sljedeća kemijska jednadžba ilustrira ovo:
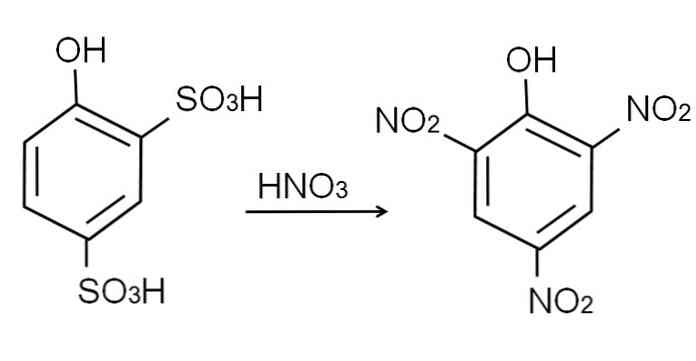
Izravno nitriranje fenola
Proces nitriranja fenola ne može se provesti izravno, jer se stvaraju velike katranske mase. Ova metoda sinteze zahtijeva vrlo pažljivu kontrolu temperature jer je vrlo egzotermna:
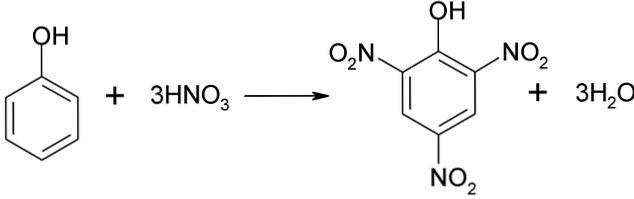
Pikrinska kiselina se može dobiti provođenjem postupka izravne nitracije 2,4-dinitrofenola s dušičnom kiselinom.
Drugi oblik sinteze je tretiranje benzena dušičnom kiselinom i živinim nitratom.
Fizikalna i kemijska svojstva
Molekularna težina
229.104 g / mol.
Fizički izgled
Masena ili žuta suspenzija vlažnih kristala.
miris
Bez mirisa je.
aroma
Vrlo je gorko.
Točka taljenja
122,5 ° C.
Točka vrenja
300 ° C. Ali kad se otopi, eksplodira.
gustoća
1,77 g / ml.
topljivost
To je spoj umjereno topljiv u vodi. To je zbog toga što su njihove OH i NO skupine2 mogu djelovati s molekulama vode putem vodikovih veza; iako je aromatski prsten hidrofoban, te je stoga njegova topivost narušena.
nagrizanje
Pikrinska kiselina je općenito nagrizajuća za metale, osim za kositar i aluminij.
pKa
0.38. To je jaka organska kiselina.
nesigurnost
Pikrinsku kiselinu karakteriziraju njena nestabilna svojstva. To predstavlja opasnost za okoliš, nestabilno je, eksplozivno i otrovno.
Čuvati dobro zatvorenu kako bi se izbjegla dehidracija, budući da je pikrinska kiselina vrlo eksplozivna ako se osuši. Svojim bezvodnim oblikom treba biti vrlo oprezan jer je vrlo osjetljiv na trenje, udarce i toplinu.
Pikrinsku kiselinu treba čuvati na ventiliranim, hladnim mjestima, dalje od materijala koji se mogu oksidirati. Nadražuje kožu i sluznicu, ne smije se progutati i toksično je za tijelo.
aplikacije
Pikrinska kiselina naširoko se koristi u istraživanjima, kemiji, industriji i vojsci.
istraživanje
Kada se koristi kao fiksator stanica i tkiva, poboljšava rezultate obojenja tih kiselina s kiselim bojama. To se događa s trikromnim bojama. Nakon fiksiranja tkiva s formalinom, preporučuje se nova fiksacija s pikrinskom kiselinom.
Na taj način zajamčena je intenzivna i vrlo svijetla boja tkiva. Dobri rezultati nisu dobiveni s osnovnim bojama. Međutim, potrebno je poduzeti mjere opreza, jer pikrinska kiselina može hidrolizirati DNA ako preostane previše vremena.
Organska kemija
-U organskoj kemiji koristi se kao alkalni pikrat za identifikaciju i analizu raznih tvari.
-Koristi se u analitičkoj kemiji metala.
-U kliničkim laboratorijima koristi se za određivanje razine kreatinina u serumu i urinu.
-Također je korišten u nekim od reagensa koji se koriste za analizu razine glukoze.
U industriji
-Na razini fotografske industrije pikrinska kiselina se koristi kao senzibilizator u fotografskim emulzijama. To je dio razvoja proizvoda kao što su pesticidi, jaki insekticidi, među ostalima.
-Pikrinska kiselina se koristi za sintezu drugih intermedijarnih kemijskih spojeva kao što su klorpikrin i pikramska kiselina, na primjer. Od tih spojeva razvijeni su neki lijekovi i boje za industriju kože.
-Pikrinska kiselina se počela primjenjivati u liječenju opeklina, kao antiseptičkih i drugih stanja, prije nego što je dokazana toksičnost.
-Važna komponenta zbog svoje eksplozivne prirode u proizvodnji šibica i baterija.
Vojne primjene
-Zbog velike eksplozivnosti pikrinske kiseline, koristi se u vojnim postrojenjima za streljivo oružja.
-Prešana i rastopljena pikrinska kiselina korištena je u artiljerijskim granatama, granatama, bombama i minama.
-Kao eksploziv koristi se amonijeva sol pikrinske kiseline, vrlo je snažna, ali manje stabilna od TNT-a. Neko je vrijeme služio kao komponenta raketnog goriva.
toksičnost
Dokazano je da je vrlo toksično za ljudsko tijelo i općenito za sva živa bića.
Preporučuje se izbjegavanje udisanja i gutanja zbog akutne oralne toksičnosti. Također uzrokuje mutacije u mikroorganizmima. Prikazuje toksične učinke na divlje životinje, sisavce i općenito u okolišu.
reference
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organska kemija. Amini. (10th izdanje.). Wiley Plus.
- Carey F. (2008). Organska kemija (Šesto izdanje). Mc Graw Hill.
- Wikipedia. (2018.). Pikrinska kiselina. Preuzeto s: en.wikipedia.org
- Sveučilište Purdue. (2004). Eksplozija pikrinske kiseline. Preuzeto s: chemed.chem.purdue.edu
- Projekt kristalografije 365. (10. veljače 2014.) Malo žućkasto - struktura pikrinske kiseline. Preuzeto s: crystallography365.wordpress.com
- Pubchem. (2019). Pikrična kiselina Preuzeto s: pubchem.ncbi.nlm.nih.gov
- Baker, J.R. (1958). Pikrična kiselina Methuen, London, UK.


