Svojstva natrijevog dikromata, proizvodnja, opasnosti i uporabe
natrijev dikromat R3 je anorganski spoj formule Na2Cr207. To je jedan od mnogih heksavalentnih spojeva kroma (Cr VI). Njegova struktura je prikazana na slici 1, iako se obično rukuje solju u njenom dihidratnom obliku čija bi formula bila Na2Cr207H2O.
Ima dvije ionske veze između molekula natrija i negativno nabijenih kisika. Kromova ruda se ekstrahira iz natrijevog dikromata. Milijuni kilograma natrijevog dikromata proizvode se godišnje.
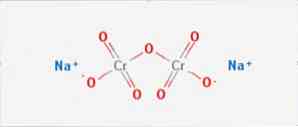
Kina je najveći proizvođač natrijevog dikromata, no kineska kemijska postrojenja imaju relativno nisku proizvodnju, manje od 50.000 tona godišnje, u usporedbi s kazahstanskim pogonom koji proizvodi više od 100.000 tona godišnje.
Postrojenja u Rusiji, Sjedinjenim Američkim Državama i Velikoj Britaniji imaju međuproizvod između 50.000 i 100.000 tona godišnje (Kogel, 2006).
U pogledu reaktivnosti i izgleda, natrijev dikromat ima svojstva slična kalijevom dikromatu, međutim, natrijeva sol je topivija u vodi i ima masu ekvivalentnu manjoj od kalijeve soli..
Natrijev dikromat stvara toksične pare kroma kada se zagrijava. To je jako sredstvo za oksidaciju i jako korozivno.
Ovaj se spoj može naći u izvorima pitke vode onečišćenim različitim industrijskim procesima kao što su tehnike galvanizacije ili galvanizacije, štavljenje kože i proizvodnja tekstila.
indeks
- 1 Fizikalna i kemijska svojstva
- 2 Metode proizvodnje
- 3 Reaktivnost i opasnosti
- 4 Uporaba i primjene
- 5 Biokemija
- 6 Reference
Fizikalna i kemijska svojstva
Natrijev dikromat sastoji se od kristala s crvenkasto narančastom monoklinskom strukturom u obliku bezvodnog i bez mirisa. Njegova molekularna težina je 261,97 g / mol u svom bezvodnom obliku i 298,00 g / mol u dihidratnom obliku..
Točka topljenja je 356,7 stupnjeva Celzijusa, vrelište od 400 stupnjeva Celzijusa u kojem se raspada. Gustoća je 2,52 g / ml.

Slika 2 prikazuje izgled natrijevog dikromata. Njegova topljivost u vodi iznosi 187 g na 100 grama na 25 stupnjeva Celzijusa, a njegova topivost u etanolu je 513,2 grama po litri pri 19,4 stupnja Celzija (Nacionalni centar za biotehnološke informacije, s.f.).
Smatra se stabilnim spojem ako se skladišti u preporučenim uvjetima i nije zapaljiv. Budući da je jako oksidacijsko sredstvo, korozivno je, au otopini je kiselina koja ima sposobnost snižavanja pH na 4 u otopini od 1% w / v..
Metode proizvodnje
Natrijev kromat može se konvertirati u dikromat kontinuiranim postupkom koji tretira sumpornom kiselinom, ugljičnim dioksidom ili kombinacijom ova dva.
Isparavanje tekućine natrijevog dikromata uzrokuje taloženje natrijevog sulfata i / ili natrijevog bikarbonata, a ti se spojevi uklanjaju prije konačne kristalizacije natrijevog dikromata..
Natrijev dikromat može se provesti u tri koraka:
- Alkalno prženje uvjeta oksidacije kromita
- Ispiranja. Ekstrakcija topljive tvari iz smjese djelovanjem tekućeg otapala
- Pretvorba natrijevog monokromata u natrijev dikromat pomoću kiseline.
Bezvodni natrijev dikromat može se pripraviti taljenjem natrijevog dihidrata dihidrata, kristalizirajućih vodenih otopina dikromata iznad 86 stupnjeva C, ili sušenjem otopina natrijevog dikromata u sprejnim sušilicama..
Otopine natrijevog dikromata na 69 i 70% w / v koriste se kao prikladan i ekonomičan način slanja količina, izbjegavajući potrebu za ručnim rukovanjem ili otapanjem kristala.
Reaktivnost i opasnosti
To je jako sredstvo za oksidaciju. Nekompatibilno s jakim kiselinama. Kontakt s zapaljivim materijalima može uzrokovati požar. Otrovne pare kromovog oksida mogu nastati u prisutnosti topline ili vatre.
Poznata "mješavina kromne kiseline" dikromata i sumporne kiseline s organskim ostacima dovodi do jake egzotermne reakcije. Ova smjesa u kombinaciji s ostacima acetona također dovodi do nasilne reakcije.
Kombinacija dikromata i sumporne kiseline s alkoholima, etanolom i 2-propanolom dovodi do jake egzotermne reakcije. Zbog pojave mnogih incidenata koji uključuju miješanje dikromat-sumporne kiseline s organskim materijalima koji se mogu oksidirati, vjerojatno je najbolje izbjegavati takve interakcije.
Kombinacija dikromata s hidrazinom je eksplozivna, a može se očekivati da je dikromatna reakcija snažna s aminima općenito. Dodavanje dehidrirane dikromatne soli anhidridu octene kiseline dovodi do konačno eksplozivne egzotermne reakcije.
Bor, silicij i dikromati tvore pirotehničke smjese. Mješavina octene kiseline, 2-metil-2-pentenala i dikromata dovodi do neobuzdane reakcije..
Udisanje prašine ili magle uzrokuje iritaciju dišnog sustava koja ponekad podsjeća na astmu. Može doći do perforacije septuma. Smatra se otrovom.
Gutanje uzrokuje povraćanje, proljev i, vrlo neuobičajeno, komplikacije želuca i bubrega. Kontakt s očima ili kožom uzrokuje lokalnu iritaciju. Ponavljano izlaganje koži uzrokuje dermatitis.
Natrijev dikromat je kancerogen kod ljudi. Postoje dokazi da heksavalentni spojevi kroma ili Cr (VI) mogu uzrokovati rak pluća kod ljudi. Pokazalo se da natrijev dikromat uzrokuje rak pluća kod životinja.
Iako natrijev dikromat nije identificiran kao teratogeni spoj ili reproduktivni rizik, poznato je da su heksavalentni spojevi kroma ili Cr (VI) teratogeni i uzrokuju oštećenja reproduktivnog sustava kao što su smanjenje plodnosti i ometanje menstrualnog ciklusa..
Natrijev dikromat može uzrokovati oštećenje jetre i bubrega, pa se mora njime upravljati s najvećom pažnjom (Odjel za zdravstvo u New Jerseyu, 2009).
U slučaju gutanja, žrtva treba piti vodu ili mlijeko; nikada ne izazivajte povraćanje. U slučaju dodira s kožom ili očima treba ga tretirati kao opekline; Isperite oči vodom najmanje 15 minuta.
Vanjske lezije se mogu utrljati s 2% -tnom otopinom natrijeva tiosulfata. U svim slučajevima potrebno je konzultirati liječnika.
Primjene i primjene
Osim njegove važnosti u proizvodnji drugih kemijskih spojeva kroma, natrijev dikromat također ima mnogo izravne uporabe kao sastojak u proizvodnji:
- Metalni završni sloj: pomaže otpornosti na koroziju i čisti metalne površine, a također pogoduje prianjanju boje.
- Organski proizvodi: koriste se kao oksidirajuća sredstva u proizvodnji proizvoda kao što su vitamin K i vosak.
- Pigmenti: upotrebljavaju se u proizvodnji anorganskih kromatnih pigmenata, gdje proizvodi niz boja stabilnih na svjetlo. Neki stupnjevi kromata također se koriste kao inhibitori korozije u donjim slojevima i prajmerima.
- Keramika: koristi se za pripremu obojenih stakala i keramičkih glazura.
- Tekstil: koristi se kao smjesa za kisele boje radi poboljšanja svojstava brzog bojenja.
- Proizvodnja krom sulfata.
(Natrijev dikromat, građevni blok za gotovo sve ostale spojeve kroma., 2010-2012.)
Natrijev dikromat Dihidrat, njegova primjena je idealna u različitim uvjetima, uključujući primjenu na visokoj temperaturi, kao što su keramičke glazure i obojeno staklo..
Kromov oksid, koji je tvrđi od drugih metalnih oksida, kao što je titan ili željezo, idealan je za okruženja gdje su temperatura i procesni uvjeti agresivni.
Ova se tvar uglavnom koristi za proizvodnju drugih spojeva kroma, ali se također koristi u bentonitnim muljevima koji se koriste u proizvodnji ulja, u konzervansima drva, u proizvodnji organskih kemikalija i kao inhibitor korozije..
Kada se pomiješa s aluminijem i kalijevim dikromatom, upotrebom alumino-termalnog procesa, kromov oksid proizvodi metalni krom visoke čistoće. To je vitalni sastojak u proizvodnji superzlitina visokih performansi koji se koriste u zrakoplovnoj industriji.
U organskoj sintezi, natrijev dikromat se koristi kao oksidacijsko sredstvo u reakcijama redukcijskih oksida u prisutnosti sumporne kiseline.
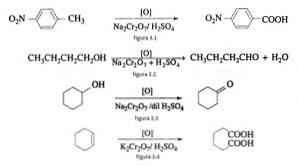
Na primjer, oksidacija p-nitrotoluena kako bi nastala p-nitrobenzojeva kiselina, u oksidaciji n-butanola kako bi nastao n-butaldehid, u formiranju cikloheksanona iz cikloheksanola i formiranje adipinske kiseline kao što je prikazano na slikama 3.1 , 3.2, 3.3 i 3.4 (VK Ahluwalia, 2004).
biokemija
Intratrahealno ukapavanje natrijevog dikromata (CrVI) i krom acetat hidroksida (CrIII) kod mužjaka štakora dovelo je do povećanja koncentracija kroma u punoj krvi, plazmi i urinu do 72 sata nakon izlaganja; Maksimalne koncentracije postignute su 6 sati nakon izlaganja.
Omjer između koncentracija kroma u punoj krvi i koncentracije kroma u plazmi bio je značajno različit za tretmane Cr (VI) i Cr (III). Stoga se za procjenu izloženosti kromu trebaju koristiti analize kroma u krvi i kroma u plazmi.
Krom je također otkriven u perifernim limfocitima. Cr (VI), ali ne i Cr (III) akumulira se značajno u limfocitima nakon tretmana. Ove stanice imaju potencijal da se koriste kao biomarkeri u procjeni izloženosti spojevima kroma (Hooth, 2008).
reference
- Natrijev dikromat. (2016). Preuzeto iz kemijskih sastojaka: cameochemicals.noaa.
- Hooth, M.J. (2008). Tehničko izvješće o studijama toksikologije i karcinogeneze natrijevog dikromata. Nacionalni institut za zdravlje SAD.
- Kogel, J.E. (2006). Industrijski minerali i stijene: sirovine, tržišta i koristi sedmo izdanje. littleton Colorado: društvo rudarstva, metalurgije i istraživanja inc.
- Nacionalni centar za biotehnološke informacije. (N. D.). PubChem Compound Database; CID = 25408. Preuzeto s pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Ministarstvo zdravstva New Jersey. (2009, studeni). natrij dikromat. Preuzeto s nj.gov: nj.gov.
- Natrijev dikromat. Građevni blok za gotovo sve ostale spojeve kroma. (2010-2012). Preuzeto iz elementis chromium: elementischromium.com
- K. Ahluwalia, R.A. (2004). Sveobuhvatna praktična organska kemija: preparati i kvantitativne analize. Delhi: Sveučilišni tisak (Indija).


