Svojstva kalcijevog hidrida (CaH2), reaktivnost i uporaba
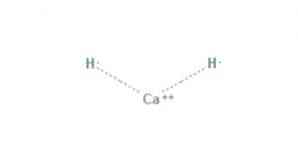
kalcijev hidrid je kemijski spoj formule CaH2, što ga čini zemnoalkalijskim hidridom. Ovaj kemijski spoj ima dvije ionske veze između kalcija i dva hidridna iona, kao što je prikazano na slici 1.
To je slan hidrid, što znači da je njegova struktura slična soli. Njegova kristalna struktura jednaka je strukturi olovnog klorida (Cotunnite mineral) kao što je prikazano na slici 2. \ t.

Svi alkalijskih metala hidrid oblik soli alkalijskih i zemno. U kemiji hidrida anion je vodik, H, ili, uobičajenije, spoj u kojem je jedan ili više vodika su nukleofilne centre, smanjenje ili bazična svojstva.
U spojevima koji se smatraju hidridima, vodikov atom je vezan za više elektropozitivni element ili skupinu.
Može se proizvesti reakcijom kalcija i vodika na temperaturi između 300 i 400 stupnjeva Celzijusa. Drugi način priprave kalcijevog hidrida je zagrijavanje kalcijevog klorida zajedno s vodikom i metalom natrija. Reakcija se događa na sljedeći način:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
U ovoj reakciji kalcij (Ca) i vodika (H) stvara molekulu kalcijev hidrid, a natrijeve atome s molekulama klora stvaranje natrij klorid (NaCl),.
Kalcijev hidrid se također može proizvesti redukcijom kalcijevog oksida (CaO) s magnezijem (Mg). Reakcija se provodi u prisutnosti vodika. Ova reakcija također proizvodi magnezijev oksid (MgO). Ispod je formula za ovu kemijsku reakciju:
CaO + Mg + H2 → CaH2 + MgO
indeks
- 1 Fizikalna i kemijska svojstva kalcijevog hidrida
- 2 Reaktivnost i opasnosti
- 3 Rukovanje i skladištenje
- 4 Uporaba i primjene
- 4.1 Sredstvo za sušenje
- 4.2 Proizvodnja vodika
- 4.3 Redukcijsko sredstvo
- 5 Nedostatak u uporabi kalcijevog hidrida
- 6 Reference
Fizikalna i kemijska svojstva kalcijevog hidrida
Kalcijev hidrid je skup kristala s bijelom ortoromskom strukturom kada je čist. Općenito, rijetko je naći u ovom obliku pa obično ima sivkastu nijansu. Nedostaje mu karakterističan miris. Njegov je izgled prikazan na slici 3 (Kraljevsko kemijsko društvo, 2015.) \ T.

Ima molekulsku masu od 42,094 g / mol, ima točku taljenja 816 stupnjeva Celzijusa i gustoću od 1,70 g / ml. Ako se otopi u vodi reagira nasilno proizvodeći vodik. Također reagira s alkoholom (Nacionalni centar za biotehnološke informacije, S.F.).
Reaktivnost i opasnosti
Kalcijev hidrid je stabilna kemikalija, iako je vrlo reaktivna na vodu ili vlagu. U dodiru s vodom oslobađa zapaljive plinove vodika koji se mogu spontano zapaliti.
Smatra se eksplozivna tvar. Kada je zagrijavana u reakciji s tetrahidrofuranom, može uzrokovati eksplozije. Kada se pomiješa s klorat, hipoklorit, bromata, kalijev perklorat, postaje osjetljiva na toplinu, trenja i eksplozivan (kalcijev hidrid 7789-78-8, 2016).
Kada se srebrni fluorid zgnječi kalcijevim hidridom, masa postaje žarka. Snažno zagrijavanje hidrida s klorom, bromom ili jodom dovodi do usijanja.
Hidridne smjese s različitim Bromati, npr barij bromata i klorat, kao što je barij klorata i perklorata kao što je kalijev perklorat, iskoristiti mljevenje. CaH2 incandescently reagira sa srebrnim fluoridom, ako predmet trenja.
Ovaj spoj se mora obraditi u inertnoj atmosferi. Ako se njima ne rukuje na odgovarajući način, to može predstavljati ozbiljnu prijetnju zdravlju i sigurnosti osoblja laboratorija, spasilaca i rukovatelja kemijskim otpadom (UC centar za laboratorijsku sigurnost, 2013).
Izuzetno opasan u slučaju dodira s kožom ili očima, jer je iritantan. Vrlo opasno u slučaju dodira s kožom jer može biti korozivno.
Također je opasno u slučaju gutanja i udisanja. Količina oštećenja tkiva ovisi o duljini kontakta. Kontakt s očima može uzrokovati oštećenje rožnice ili sljepoću.
Kontakt s kožom može uzrokovati upalu i mjehuriće. Udisanje prašine uzrokovat će iritaciju gastrointestinalnog ili respiratornog trakta, karakterizirano spaljivanjem, kihanjem i kašljanjem.
Teška prekomjerna izloženost može uzrokovati oštećenje pluća, gušenje, nesvjesticu pa čak i smrt. Upalu oka karakterizira crvenilo, iritacija i svrbež. Upalu kože karakterizira svrab, piling, crvenilo ili povremeno stvaranje mjehura.
Ponovljeno izlaganje očiju niskoj razini može uzrokovati iritaciju očiju. Ponavljano izlaganje koži može uzrokovati lokalno uništavanje kože ili dermatitis.
Ponovljeno udisanje prašine može uzrokovati različiti stupanj iritacije dišnog sustava ili oštećenja pluća. Ponavljano ili produljeno udisanje prašine može uzrokovati kroničnu iritaciju dišnog sustava (Sigurnosno-tehnički list s materijalima, kalcijev hidrid, MSDS, 2005).
U slučaju kontakta s očima odmah ih isprati s puno vode najmanje 15 minuta, povremeno podižući gornje i donje kapke..
U slučaju kontakta s kožom odmah isprati s puno vode najmanje 15 minuta, pri čemu treba ukloniti kontaminiranu odjeću i obuću.
U slučaju gutanja, povraćanje se ne smije izazvati. Trebalo bi nazvati centar za kontrolu otrova. Preporučljivo je napustiti izložbeni prostor i odmah se preseliti na otvoreno.
U slučaju udisanja, ako je disanje otežano, potrebno je dostaviti kisik. Ne smije se davati disanje od usta do usta ako je žrtva progutala ili udahnula tvar.
Umjetno disanje treba potaknuti pomoću džepne maske opremljene jednosmjernim ventilom ili drugim prikladnim medicinskim uređajem za disanje. U svim slučajevima treba odmah dobiti liječničku pomoć.
Rukovanje i skladištenje
Spoj treba držati u suhom spremniku dalje od topline. Držite ga podalje od izvora paljenja. Nemojte udisati prašinu. U ovaj proizvod ne treba dodavati vodu
U slučaju nedovoljne ventilacije nositi odgovarajuću opremu za disanje kao što je filtarska maska. U slučaju izlaganja, trebate potražiti liječničku pomoć i pokazati naljepnicu što je više moguće. Izbjegavajte kontakt s kožom i očima.
Zapaljivi materijali, općenito, trebaju biti pohranjeni u odvojenom sigurnosnom ormaru ili spremištu. Čuvajte posudu čvrsto zatvorenu.
Čuvati na hladnom i dobro prozračenom mjestu. Sva oprema koja sadrži materijal za izbjegavanje električnih iskri mora biti uzemljena. Spremnik treba čuvati na suhom i hladnom mjestu.
To je nezapaljiv materijal. Međutim, vatrogasci moraju nositi odgovarajuću opremu za gašenje požara oko tog kemijskog spoja.
Nikada nije preporučljivo koristiti vodu za gašenje požara oko kalcijevog hidrida. Može se upotrijebiti suhi pijesak, kao i spojeve kao što su natrijev klorid i natrijev karbonat.
Da bi se uklonio otpad kalcijevog hidrida, mora se razgraditi dodavanjem 25 ml metanola za svaki gram hidrida u atmosferi dušika uz miješanje..
Po završetku reakcije, dodaje se isti volumen vode u vodenu otopinu kalcijevog metoksida i ispušta se u odvod obilnom količinom vode (National Research Council, 1995)..
Primjene i primjene
Sredstvo za sušenje
Kalijev hidrid je relativno blag sušač. Zbog toga je upotreba ovog spoja kao sredstva za sušenje sigurnija u usporedbi s više reaktivnim sredstvima, kao što su natrijeve kalijeve i natrijeve metalne legure. Reagira s vodom na sljedeći način:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Hidrolize su produkti ove reakcije, vodik (plin) i Ca (OH) 2 (vodena smjesa) može se odvojiti od otapala kemijske nakon filtracije, destilacijom ili dekantiranje.
Ovaj kemijski spoj je djelotvorno sredstvo za sušenje za mnoga osnovna otapala kao što su amini i piridin. Ponekad se koristi za prethodno sušenje otapala prije upotrebe više reaktivnih desikanata.
Proizvodnja vodika
U 1940-ima, ovaj spoj je bio dostupan kao izvor vodika pod trgovačkim nazivom "Hydrolith".
Dugo je korišten kao izvor vodika. I dalje se koristi za proizvodnju čistog vodika u laboratorijima za različite pokuse, napredne gorivne ćelije i primjene baterija (American Elements, S.F.).
Spoj se već desetljećima koristi kao siguran i pogodan način napuhavanja balona.
Isto tako, redovito se koristi u laboratorijima za proizvodnju malih količina vrlo čistog vodika za pokuse. Sadržaj vlage u dizelskom gorivu izračunava se pomoću vodika nastalog nakon obrade s CaH2.
Redukcijsko sredstvo
Kada zagrijava između 600 i 1000 ° C, što cirkonij oksid, niobija, urana, kroma, titan, vanadij i tantala može se smanjiti za pripravu praška ovih metala, kalcijev hidrid i mogu se koristiti u metalurgiji prašina.
Sljedeća reakcija ilustrira način na koji kalcijev hidrid djeluje kao redukcijsko sredstvo:
TiO + 2CaH2 → CaO + H2 + Ti
Nedostatak u uporabi kalcijevog hidrida
Ovaj kemijski spoj je često poželjan izbor kao sredstvo za sušenje; Međutim, ima i neke nedostatke:
-Djelovanje sušenja ovog spoja je sporo, jer nije topljivo u bilo kojem otapalu s kojim ne reagira nasilno.
-Ovaj praškasti spoj nije kompatibilan s mnogim otapalima. Vaša reakcija s klorovim ugljikovodicima može čak izazvati eksplozije.
-Ne može se koristiti za otapala s deoksigenacijom, jer ne može eliminirati otopljeni kisik.
-Razlikovanje kalcijevog hidrida i kalcijevog hidroksida je vrlo teško zbog sličnog izgleda.
reference
- Američki elementi. (S.F.). kalcijev hidrid. Preuzeto s americanelements.com: americanelements.com.
- Kalcijev hidrid 7789-78-8. (2016). Dobavljeno iz chemicalbook.com: chemicalbook.com.
- kalcijev hidrid. (N. D.). Preuzeto iz kemije učenik: chemistrylearner.com.
- List s podacima o sigurnosti materijala Kalcijev hidrid MSDS. (2005., 10. listopada). Dobavljeno iz sciencelab.com: sciencelab.com.
- Nacionalni centar za biotehnološke informacije. (S.F.). PubChem Compound Database; CID = 105052. Preuzeto s pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- nacionalno istraživačko vijeće. (1995). Razborite prakse u laboratoriju: rukovanje i odlaganje kemikalija. Washinton: NationalAcademy Press.
- Kraljevsko kemijsko društvo. (2015). kalcijev hidrid ID 94784. Preuzeto s chemspider.com: chemspider.com.
- UC centar za laboratorijsku sigurnost. (2013., 18. siječnja). standardni radni postupak kalcijev hidrid. Dobavljeno iz chemengr.ucsb.edu: chemengr.ucsb.edu.


