Kemijska struktura, svojstva i primjena berilijevog hidrida (BeH2)
berilijev hidrid Izraz "kovalentni spoj" je kovalentni spoj formiran između berilija i zemnoalkalnog metala i vodika. Njegova kemijska formula je BeH2, i da je kovalentan, ne sastoji se od Be iona2+ niti H-. To je, zajedno s LiH, jedan od najlakših metalnih hidrida koji se mogu sintetizirati.
Proizvodi se tretiranjem dimetilberila, Be (CH3)2, s litij aluminij hidridom, LiAlH4. Međutim, BeH2 Najčišći se dobiva iz pirolize di-terc-butilberilija, Be (C (CH3)3)2 na 210 ° C.

Kao pojedinačna molekula u plinovitom stanju, ona je linearna u geometriji, ali u čvrstom i tekućem stanju polimerizira u nizovima trodimenzionalnih mreža. To je amorfna krutina pod normalnim uvjetima, i može postati kristalinična i pokazati metalna svojstva pod ogromnim tlakom.
Predstavlja mogući način skladištenja vodika, bilo kao izvora vodika pri razgradnji, ili kao kruti apsorbirajući plin. Međutim, BeH2 Vrlo je toksičan i zagađuje obzirom na vrlo polarizirajuću prirodu berilija.
indeks
- 1 Kemijska struktura
- 1.1 Molekula BeH2
- 1.2 Lanci BeH2
- 1.3 Trodimenzionalne mreže BeH2
- 2 Svojstva
- 2.1 Kovalentni karakter
- 2.2 Kemijska formula
- 2.3 Fizički izgled
- 2.4 Topljivost u vodi
- 2.5 Topljivost
- 2.6 Gustoća
- 2.7 Reaktivnost
- 3 Upotreba
- 4 Reference
Kemijska struktura
Molekula BeH2
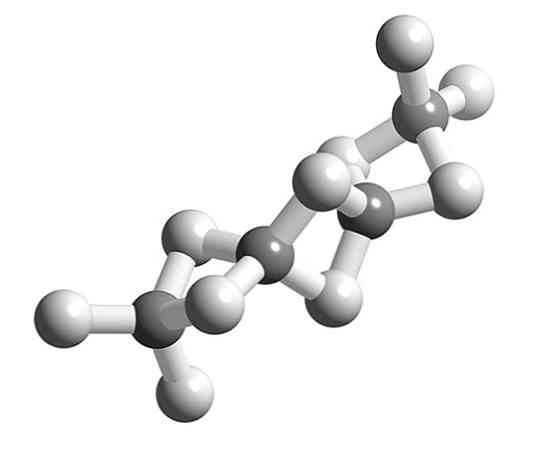
Na prvoj slici može se vidjeti pojedinačna molekula berilijeva hidrida u plinovitom stanju. Imajte na umu da je njegova geometrija linearna, s atomima H međusobno odvojenim za kut od 180º. Da bi objasnio takvu geometriju, atom Be mora imati sp hibridizaciju.
Berilij ima dva valentna elektrona koji se nalaze u orbitalnoj 2s. Prema teoriji valentnih veza, jedan od elektrona iz orbite 2s je energetski promaknut u orbitalu 2p; i kao posljedica toga, on sada može formirati dvije kovalentne veze s dvije sp hibridne orbitale.
A što je s ostalim slobodnim orbitalima Be? Dostupne su još dvije čiste 2p orbitale, nehibridizirane. S njima su prazni, BeH2 to je manjkav spoj elektrona u plinovitom obliku; i stoga, hlađenjem i grupiranjem njihovih molekula, one se kondenziraju i kristaliziraju u polimeru.
BeH Lanci2
Kada se molekule BeH2 polimerizacijom, okolna geometrija atoma Be prestaje biti linearna i postaje tetraedarska.
Prethodno je struktura ovog polimera modelirana kao da su lanci s BeH jedinicama2 povezane vodikovim mostovima (gornja slika, s kuglicama u bijelim i sivim tonovima). Za razliku od vodikovih veza dipol-dipolnih interakcija, one imaju kovalentni karakter.
U Be-H-Be mostu polimera, dva elektrona su raspodijeljena između tri atoma (link 3c, 2e), koji se teoretski mora nalaziti vjerojatnije oko atoma vodika (jer je elektronegativniji).
S druge strane, Be okružena s četiri H uspijeva popuniti relativno svoje elektronsko radno mjesto, dovršavajući svoj valentni oktet.
Ovdje teorija valentnih veza blijedi da bi dala relativno točno objašnjenje. Zašto? Budući da vodik može imati samo dva elektrona, a -H-veza bi uključivala sudjelovanje četiri elektrona.
Dakle, objasniti Be-H mostove2-Be (dvije sive kuglice povezane s dvije bijele kuglice) trebaju druge složene modele veze, kao što su one koje pruža teorija molekularne orbite..
Eksperimentalno je utvrđeno da polimerna struktura BeH2 To zapravo nije lanac, već trodimenzionalna mreža.
Trodimenzionalne mreže BeH2
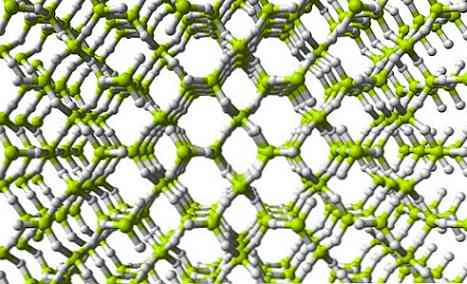
Gornja slika prikazuje dio trodimenzionalne BeH mreže2. Zapazite da žućkasto zelene sfere, atomi Be, tvore tetraedar kao u lancu; međutim, u ovoj strukturi postoji veći broj vodikovih mostova, a osim toga, strukturna jedinica više nije BeH2 ali BeH4.
Iste strukturne jedinice BeH-a2 i BeH4 oni ukazuju da u mreži postoji veća količina vodikovih atoma (4 H atoma za svaku Be).
To znači da berilij unutar te mreže uspijeva popuniti svoje elektroničko radno mjesto čak i više nego unutar lančane polimerne strukture..
I kao najočitija razlika ovog polimera s obzirom na pojedinačnu molekulu BeH2, je da Be mora nužno imati sp hibridizaciju3 (Obično) za objašnjenje tetraedarske i nelinearne geometrije.
nekretnine
Kovalentni znak
Zašto je berilijev hidrid kovalentni i neionski spoj? Hidridi ostalih elemenata skupine 2 (g. Becamgbara) su ionski, tj. Sastoje se od krutina nastalih pomoću M kationa.2+ i dva hidridna aniona H- (MGH2, CaH2, Bah2). Stoga, BeH2 Ne sastoji se od Be2+ niti H- interakcija elektrostatski.
Kation Be2+ karakterizira ga visoka polarizirajuća snaga koja iskrivljuje elektroničke oblake okolnih atoma.
Kao rezultat ove distorzije, H anioni- prisiljeni su formirati kovalentne veze; veze, koje su temelj upravo objašnjenih struktura.
Kemijska formula
BEH2 ili (BeH2) n
Fizički izgled
Bezbojna amorfna krutina.
Topljivost u vodi
Pada.
topljivost
Netopljiv u dietil eteru i toluenu.
gustoća
0.65 g / cm3 (1.85 g / L). Prva vrijednost može se odnositi na plinsku fazu, a druga na polimernu krutinu.
reaktivnost
Polagano reagira s vodom, ali se brzo hidrolizira s HCl da nastane berilijev klorid, BeCl2.
Berilijev hidrid reagira s Lewisovim bazama, posebno trimetilaminom, N (CH)3)3, kako bi se formirao dimerni adukt, s hidridima mostova.
Također, on može reagirati s dimetilaminom kako bi se formirao trimerni berilijev diamid, [Be (N (CH3)2)2]3 i vodik. Reakcija s litijevim hidridom, gdje je ion H- je baza Lewisa, formira se sekvencijalno LIBeH3 i Li2BEH4.
aplikacije
Berilijev hidrid može predstavljati obećavajući način za pohranu molekularnog vodika. Razgradnjom polimera, oslobađa se H2, koja bi služila kao raketno gorivo. Iz ovog pristupa, trodimenzionalna mreža bi skladištila više vodika od lanaca.
Također, kao što se može vidjeti na slici mreže, postoje pore koje će omogućiti domaćinstvo H molekula.2.
Zapravo, neke studije simuliraju kakva bi fizička pohrana bila u BeH2 kristalni; to jest, polimer podvrgnut enormnim tlakovima, a što su njegova fizička svojstva s različitim količinama adsorbiranog vodika.
reference
- Wikipedia. (2017). Berilijev hidrid. Preuzeto s: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Theoret. Chim. Acta (1979) Elektronske strukture polimernog berilijevog hidrida i polimernog bor hidrida. 51: 163. doi.org/10.1007/BF00554099
- Poglavlje 3: Berilijev hidrid i njegovi oligomeri. Preuzeto s: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger i U. P. Verma. (2014). Studija strukturnog i elektroničkog ponašanja BeH2 kao spoj za pohranjivanje vodika: Ab initio pristup. Konferencijski radovi u znanosti, vol. 2014, ID članka 807893, 5 stranica. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Anorganska kemija U Elementi skupine 1. (Četvrto izdanje). Mc Graw Hill.


