Stroncij hidroksid (Sr (OH) ₂) kemijska struktura, svojstva i uporaba
stroncij hidroksid (Sr (OH) ₂) je anorganski kemijski spoj koji se sastoji od stroncijevog iona (Sr) i dvaju hidroksidnih (OH) iona. Ovaj spoj se dobiva kombiniranjem stroncijeve soli s jakom bazom, što rezultira spojem alkalne prirode čija je kemijska formula Sr (OH)2.
Općenito, natrijev hidroksid (NaOH) ili kalijev hidroksid (KOH) se koristi kao jaka baza za pripravu stroncijevog hidroksida. S druge strane, stroncijova sol (ili stroncijev ion) koja reagira s jakom bazom je stroncij nitrat Sr (NO3)2 a postupak je opisan sljedećom kemijskom reakcijom:
2KOH + Sr (NO3)2 → 2KNO3 + Sr (OH)2
U otopini stroncij kation (Sr+) stavi u kontakt s hidroksidnim anionom (OH-) formiranje osnovne ionske soli stroncija. Budući da je stroncij zemno alkalijski metal, stroncij hidroksid se smatra kaustičnim alkalnim spojem.
indeks
- 1 Dobivanje
- 2 Kemijska struktura i fizikalno-kemijska svojstva
- 2.1 Octahidrat stroncijevog hidroksida
- 2.2 Stroncijev hidroksid monohidrat
- 2.3 Bezvodni stroncij hidroksid
- 2.4 Topljivost
- 2.5 Kemijska reaktivnost
- 3 Upotreba
- 3.1. Ekstrakcija melase i rafiniranje šećerne repe
- 3.2 Stroncij masti
- 3.3 Plastični stabilizator
- 3.4 Ostale aplikacije
- 4 Reference
dobivanje
Osim prethodno objašnjenog postupka, može se reći da kada je reakcija provedena, Sr (OH)2 taloži se u otopini. Zatim se podvrgava procesu pranja i sušenja, te na kraju dobiva vrlo fini bijeli prah.
Alternativna metoda za dobivanje stroncijevog hidroksida je zagrijavanje stroncijevog karbonata (SrCO)3) ili stroncij sulfat (SrSO)4) s parom na temperaturi između 500 ° C i 600 ° C. Do kemijske reakcije dolazi kako je prikazano u nastavku:
SrCO3 + H2O → Sr (OH)2 + CO2
SrS + 2H2O → Sr (OH)2 + H2S
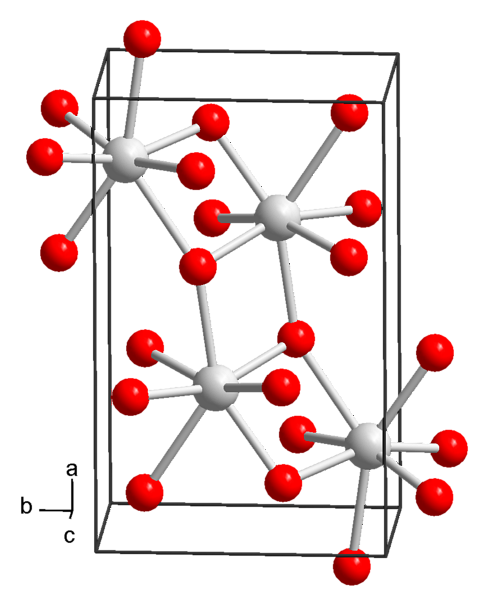
Kemijska struktura i fizičko-kemijska svojstva
Trenutno su poznata 3 oblika stroncijevog hidroksida: oktahidrat, monohidrat i bezvodni.
Stroncij hidroksid oktahidrat
Od otopina pod normalnim uvjetima temperature i tlaka (25 ° C i 1 atm), stroncij hidroksid se taloži u oktahidiranom obliku, čija je kemijska formula Sr (OH)28H2O.
Ovaj spoj ima molarnu masu 265,76 g / mol, gustoću od 1,90 g / cm i taloži se kao tetragonalni kristali (s prostornom skupinom P4 / ncc) četverokutnog i bezbojnog prizmatičnog izgleda.
Također, stroncijev hidroksid oktahidrat ima sposobnost apsorbiranja atmosferske vlage, jer je spoj lako rastopljiv..
Monohidrat stroncijevog hidroksida
Prema istraživanjima optičke mikroskopije (izvedena tehnikom difrakcije X-zraka), podizanjem temperature na oko 210 ° C - pri konstantnom atmosferskom tlaku - Sr (OH)28H2Ili se dehidrira i transformira u stroncij hidroksid monohidrat (Sr (OH))2H2O).
Ovaj oblik spoja ima molarnu masu od 139,65 g / mol, a temperatura taljenja je -73,15 ° C (375 K). Zbog svoje atomske konfiguracije, ona ima manju topljivost u vodi od one opisane u oktahidiranom obliku.
Bezvodni stroncij hidroksid
Nastavkom povećanja temperature sustava na oko 480 ° C, dehidracija se nastavlja sve dok se ne dobije bezvodni stroncij hidroksid..
Za razliku od svojih hidratiziranih oblika, ona ima molarnu masu od 121,63 g / mol i gustoću od 3,625 g / cm3. Vrelište je dostignuto na 710 ° C (1.310 ° F ili 983 K) dok je talište na 535 ° C (995 ° F ili 808 K).
topljivost
Oktahidrirani hidroksid stroncija ima topljivost u vodi od 0,91 grama na 100 mililitara (mjereno na 0 ° C), a bezvodni oblik u sličnim temperaturnim uvjetima ima topivost 0,41 grama na 100 mililitara..
Na isti način, ova se tvar smatra netopljivom u acetonu i potpuno topljiva u kiselinama i amonijevom kloridu.
Kemijska reaktivnost
Stroncijev hidroksid nije zapaljiv, njegova kemijska reaktivnost ostaje stabilna pri umjerenim temperaturama i tlakovima i sposobna je apsorbirati ugljični dioksid iz atmosferskog zraka, pretvarajući ga u stroncij karbonat.
Osim toga, to je jako nadražujuća smjesa ako dođe u dodir s kožom, dišnim putevima ili drugim područjima sluznice tijela..
aplikacije
Zbog svojih higroskopskih svojstava i osnovnih svojstava, stroncij hidroksid se koristi za različite primjene u industriji:
- Ekstrakcija melase i rafiniranje šećera iz repe.
- Plastični stabilizator.
- Masti i maziva.
Ekstrakcija melase i rafiniranje šećerne repe
Početkom 21. stoljeća, stroncij hidroksid je korišten u Njemačkoj za rafiniranje šećera iz repa procesom koji je patentirao Carl Scheibler 1882..
Ovaj postupak se sastoji od miješanja stroncij hidroksida i šećerne pulpe repe, što rezultira netopljivim disaharidom. Ta se otopina odvaja dekantiranjem i nakon što se provede postupak rafiniranja, dobiva se šećer kao konačni proizvod.
Iako se ovaj postupak i danas koristi, postoje i druge metode s mnogo većom potražnjom, jer su one jeftinije, koje se koriste u velikoj većini svjetskih rafinerija. Na primjer, Barsilova metoda, koja koristi barijev silikat ili steffen metodu koristeći Cal kao sredstvo za ekstrakciju.
Stroncij masti
To su mazive masti koje sadrže stroncij hidroksid. Oni se mogu čvrsto držati površina s metalnim karakteristikama, otporne su na vodu i izdržati nagle promjene temperature.
Zbog njihove dobre fizikalne i kemijske stabilnosti, te se masti koriste kao industrijska maziva.
Plastični stabilizator
Velika većina plastike izložena klimatskim čimbenicima kao što su sunce, kiša i atmosferski kisik, mijenjaju svoja svojstva i degradaciju.
Zbog svoje velike otpornosti na vodu, stroncijev hidroksid se dodaje ovim polimerima - tijekom fuzijske faze - djeluje kao stabilizator u proizvodnji plastičnih proizvoda kako bi produžio njihov vijek trajanja.
Ostale aplikacije
- U industriji boja se koristi kao bitan aditiv za ubrzavanje procesa sušenja u komercijalnim i industrijskim bojama.
- Stroncijeve soli ili stroncijevi ioni dobivaju se iz stroncijevog hidroksida i koriste se kao sirovina za proizvodnju pirotehničkih proizvoda.
reference
- Wikipedia. (N. D.). Stroncij hidroksid. Preuzeto s en.wikipedia.org
- Pubchem. (N. D.). Stroncij hidroksid. Preuzeto s pubchem.ncbi.nlm.nih.gov
- Lambert, I. i Clever, H. L. (2013). Hidroksidi alkalne zemlje u vodi i vodenim otopinama. Preuzeto s books.google.co.ve
- Krebs, R.E. (2006). Povijest i korištenje kemijskih elemenata naše zemlje: referentni vodič. Preuzeto s books.google.co.ve
- Honeywell. (N. D.). Stroncij hidroksid oktahidrat. Oporavio se od honeywell.com


