Endotermičke reakcijske karakteristike, jednadžbe i primjeri
endotermna reakcija to je ono što se mora odvijati kako bi apsorbiralo energiju, u obliku topline ili zračenja, iz okolice. Općenito, iako ne uvijek, mogu se prepoznati po padu temperature u njihovoj okolini; ili, naprotiv, trebaju izvor topline, poput onog dobivenog plamenom koji gori.
Apsorpcija energije ili topline je ono što je zajedničko svim endotermnim reakcijama; Priroda istih, kao i uključene transformacije, vrlo su raznolike. Koliko topline trebaju apsorbirati? Odgovor ovisi o njegovoj termodinamici: temperaturi na kojoj se reakcija događa spontano.

Na primjer, jedna od najznačajnijih endotermnih reakcija je promjena stanja od leda do tekuće vode. Led mora apsorbirati toplinu dok temperatura ne dostigne približno 0ºC; na toj temperaturi njegovo topljenje postaje spontano, a led će se apsorbirati dok se potpuno ne otopi.
U vrućim prostorima, kao što je na obalama plaže, temperature su veće i stoga led brže upija toplinu; to jest, topi se pri većoj brzini. Otapanje ledenjaka je primjer nepoželjne endotermne reakcije.
Zašto se tako događa? Zašto se led ne može predstaviti kao vruća kruta tvar? Odgovor leži u prosječnoj kinetičkoj energiji molekula vode u oba stanja, te kako one međusobno djeluju preko svojih vodikovih veza.
U tekućoj vodi, njegove molekule imaju veću slobodu kretanja nego u ledu, gdje vibriraju stacionarno u svojim kristalima. Da bi se pomaknula, molekule moraju apsorbirati energiju na takav način da njihove vibracije razbijaju jake smjerove vodikovih mostova u ledu.
Zbog toga led apsorbira toplinu kako bi se otopio. Da bi postojao "vrući led", vodikovi mostovi bi morali biti abnormalno jaki da bi se istopili na temperaturi iznad 0 ° C.
indeks
- 1 Značajke endotermne reakcije
- 1.1 AH> 0
- 1.2 Osvježite okolinu
- 2 Jednadžbe
- Primjeri uobičajenih endotermnih reakcija
- 3.1 Isparavanje suhog leda
- 3.2 Pečenje kruha ili kuhanje hrane
- 3.3 Sunčanje
- 3.4 Reakcija atmosferskog dušika i stvaranja ozona
- 3.5 Elektroliza vode
- 3.6 Fotosinteza
- 3.7 Otopine nekih soli
- 3.8 Toplinska razgradnja
- 3.9 Amonijev klorid u vodi
- 3.10 Natrijev triosulfat
- 3.11 Automobilski motori
- 3.12
- 3.13 Kuhanje jaja
- 3.14 Kuhanje hrane
- 3.15 Zagrijavanje hrane u mikrovalnoj pećnici
- 3.16 Oblikovanje stakla
- 3.17 Potrošnja svijeće
- 3.18 Čišćenje vrućom vodom
- 3.19 Toplinska sterilizacija hrane i drugih predmeta
- 3.20 Borba protiv infekcija s vrućicom
- 3.21 Isparavanje vode
- 4 Reference
Značajke endotermne reakcije
Promjena stanja nije ispravna kemijska reakcija; međutim, isto se događa: proizvod (tekuća voda) ima više energije nego reaktant (led). To je glavna karakteristika reakcije ili endotermnog procesa: proizvodi su energetski učinkovitiji od reaktanata.
Iako je to istina, to ne znači da proizvodi nužno moraju biti nestabilni. U slučaju da je, endotermna reakcija prestaje spontano u svim uvjetima temperature ili tlaka.
Razmotrite sljedeću kemijsku jednadžbu:
A + Q => B
Gdje Q predstavlja toplinu, obično izraženu jedinicama džula (J) ili kalorija (kal). Budući da A apsorbira toplinu Q da bi se transformirala u B, tada se kaže da je to endotermna reakcija. Dakle, B ima više energije nego A, i mora apsorbirati dovoljno energije da bi postigla svoju transformaciju.
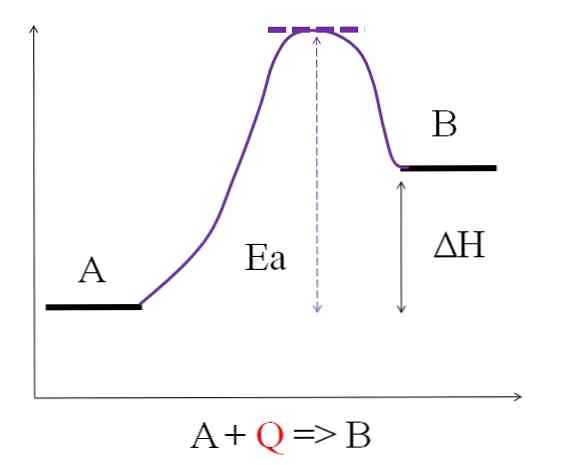
Kao što se može vidjeti na gornjem dijagramu, A ima manje energije od B. Količina topline Q koja apsorbira A je takva da nadilazi aktivacijsku energiju (energiju potrebnu da dosegne ljubičasti vrh s točkastim krovom). Energetska razlika između A i B je ono što je poznato kao entalpija reakcije, ΔH.
H> 0
Sve endotermne reakcije zajedničke su prethodnom dijagramu, budući da su proizvodi energetski učinkovitiji od reaktanata. Stoga je razlika energije između njih ΔH uvijek pozitivna (Hproizvod-Hreagens > 0). Kada je to istina, mora postojati apsorpcija topline ili energije iz okoline za opskrbu ove energetske potrebe.
I kako se takvi izrazi tumače? U kemijskoj reakciji veze su uvijek razbijene da bi stvorile druge. Da bi ih slomili, apsorpcija energije je potrebna; to jest, to je endotermni prolaz. U međuvremenu, formiranje veza podrazumijeva stabilnost, pa je to egzotermni korak.
Kada nastale veze ne pružaju stabilnost usporedivu s količinom energije potrebne za razbijanje starih veza, to je endotermna reakcija. Zato je potrebna dodatna energija za promicanje razbijanja najstabilnijih veza u reagensima.
S druge strane, u egzotermnim reakcijama dolazi do suprotnog: toplina se oslobađa, a ΔH < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Hlade okolinu
Iako se ne odnosi na sve endotermne reakcije, neke od njih uzrokuju smanjenje temperature okoline. To je zato što apsorbirana toplina dolazi odnekud. Prema tome, ako se konverzija A i B prenese u kontejner, ona će se ohladiti.
Što je reakcija endotermnija, to će hladnjak i okolina postati hladniji. Zapravo, neke reakcije mogu stvoriti tanak ledeni pokrov, kao da su izašli iz hladnjaka.
Međutim, postoje reakcije ovog tipa koje ne ohlađuju okolinu. Zašto? Zato što je toplina okoline nedovoljna; to jest, ne daje nužan Q (J, cal) koji je napisan u kemijskim jednadžbama. Stoga ovdje dolazi do pojave požara ili ultraljubičastog zračenja.
Između oba scenarija može doći do male zbrke. S jedne strane, toplina okoline dovoljna je da se reakcija odvija spontano, i uočava se hlađenje; s druge strane, potrebno je više topline i koristi se učinkovita metoda grijanja. U oba slučaja događa se ista stvar: energija se apsorbira.
jednadžbe
Koje su relevantne jednadžbe u endotermnoj reakciji? Kao što je već objašnjeno, ΔH mora biti pozitivan. Da bi se izračunao, prvo se smatra sljedeća kemijska jednadžba:
aA + bB => cC + dD
Gdje su A i B reaktantne tvari, a C i D su proizvodi. Mala slova (a, b, c i d) su stehiometrijski koeficijenti. Za izračunavanje ΔH ove generičke reakcije primjenjuje se sljedeći matematički izraz:
AHproizvoditi- AHreagensi = AHreakc
Možete nastaviti izravno ili računati zasebno. Za ΔHproizvoditi sljedeći se iznos mora izračunati:
cFC + d AHFD
Gdje je ΔHF to je entalpija stvaranja svake tvari uključene u reakciju. Prema konvenciji, tvari u njihovim najstabilnijim oblicima imaju ΔHF= 0 Na primjer, O molekule2 i H2, ili čvrsti metal, oni imaju ΔHF= 0.
Isti izračun sada je učinjen za reaktante, ΔHreagensi:
do ΔHFA + b AHFB
Ali kao što jednadžba kaže da je ΔHreagensi mora se oduzeti od ΔHproizvoditi, tada se prethodni zbroj mora pomnožiti s -1. Imate:
cFC + d AHFD - (u ΔHFA + b AHFB)
Ako je rezultat ovog izračuna pozitivan broj, onda je to endotermna reakcija. Ako je negativna, to je egzotermna reakcija.
Primjeri uobičajenih endotermnih reakcija
Isparavanje suhog leda

Tko god je vidio te bijele pare koje izviru iz kolica za sladoled, svjedočio je jednom od najčešćih primjera endotermne "reakcije".
Osim nekoliko sladoleda, ovi isparenja odvojena od čvrste bijele boje, nazvana suhim ledom, također su dio scenarija za stvaranje efekta izmaglice. Taj suhi led nije ništa drugo nego čvrsti ugljični dioksid koji apsorbira temperaturu i prije nego što vanjski tlak počne sublimirati.
Eksperiment za dječju publiku bio bi ispuniti i zatvoriti vrećicu suhim ledom. Nakon nekog vremena završit će se napuhavanjem zbog CO2 plinoviti, koji stvara rad ili pritiska unutarnje stijenke vrećice na atmosferski tlak.
Pečenje kruha ili kuhanje hrane

Pečenje kruha je primjer kemijske reakcije, jer sada dolazi do kemijskih promjena uslijed topline. Tko god miriše miris svježe pečenog kruha, zna da dolazi do endotermne reakcije.
Za tijesto i sve njegove sastojke potrebna je toplina peći kako bi se provele sve transformacije, neophodne da postanu kruh i pokazuju njegove karakteristične osobine.
Osim kruha, kuhinja je puna primjera endotermnih reakcija. Tko kuhari s njima postupaju svakodnevno. Kuhanje tjestenine, omekšavanje zrna, zagrijavanje zrna kukuruza, pečenje jaja, začinsko meso, pečenje kolača, pripremanje čaja, grijanje sendviča; svaka od tih aktivnosti su endotermne reakcije.
sunčanje

Koliko god jednostavni i uobičajeni izgledaju, sunčanje koje neki gmazovi uzimaju, kao što su kornjače i krokodili, spadaju u kategoriju endotermnih reakcija. Kornjače apsorbiraju toplinu sunca kako bi regulirale temperaturu svog organizma.
Bez sunca, oni zadržavaju toplinu vode da bi se zagrijali; što završava hlađenje vode u spremnicima ili ribama.
Reakcija atmosferskog dušika i stvaranja ozona

Zrak se uglavnom sastoji od dušika i kisika. Tijekom oluje, oslobađa se energija koja može razbiti jake veze koje drže dušikove atome zajedno u N-molekuli.2:
N2 + O2 + Q => 2NO
S druge strane, kisik može apsorbirati ultraljubičasto zračenje da postane ozon; alotrop kisika koji je vrlo koristan u stratosferi, ali štetan za život na razini tla. Reakcija je:
3O2 + v => 203
Gdje v znači ultraljubičasto zračenje. Mehanizam iza te jednostavne jednadžbe je vrlo složen.
Elektroliza vode
Elektroliza koristi električnu energiju za razdvajanje molekula u elementima ili stvaranje molekula. Na primjer, u elektrolizi vode nastaju dva plina: vodik i kisik, svaki u različitim elektrodama:
2H2O => 2H2 + O2
Isto tako, natrijev klorid može podnijeti istu reakciju:
2NaCl => 2Na + Cl2
U jednoj elektrodi vidjet ćete stvaranje metalnog natrija, au drugim zelenkastim mjehurićima klora.
fotosinteza

Biljke i drveće moraju apsorbirati sunčevu svjetlost kao izvor energije kako bi sintetizirali svoje biomaterijale. Za to koristi CO kao sirovinu2 i voda, koja se kroz dugi niz koraka pretvara u glukozu i druge šećere. Osim toga, stvara se kisik koji se oslobađa iz lišća.
Otopine nekih soli
Ako se natrijev klorid otopi u vodi, neće se primijetiti zamjetna promjena vanjske temperature posude ili spremnika..
Neke soli, poput kalcijevog klorida, CaCl2, povećati temperaturu vode kao produkt velike hidratacije Ca iona2+. I druge soli, kao što je nitrat ili amonijev klorid, NH4NE3 i NH4Cl, smanjite temperaturu vode i ohladite okolinu.
U učionicama se obično rade domaći eksperimenti koji otapaju neke od ovih soli kako bi pokazali što je endotermna reakcija.
Smanjenje temperature je posljedica hidratacije NH iona4+ on nije pogodan protiv otapanja kristalnih oblika njegovih soli. Prema tome, soli apsorbiraju toplinu iz vode kako bi se omogućilo solvatiranje iona.
Druga kemijska reakcija koja je obično vrlo česta da bi se to pokazalo je sljedeće:
Ba (OH)2· 8H2O + 2NH4NE3 => Ba (NO3)2 + 2NH3 +10 H2O
Zabilježite količinu nastale vode. Miješanjem obje čvrste tvari dobiva se vodena otopina Ba (NO3)2, s mirisom amonijaka i takvim padom temperature koji doslovno zamrzava vanjsku površinu spremnika.
Toplinska razgradnja
Jedna od najčešćih termičkih razgradnji je natrijev bikarbonat, NaHCO3, za proizvodnju CO2 i kada se zagrije. Mnoge krute tvari, uključujući karbonate, imaju tendenciju razgradnje da bi oslobodile CO2 i odgovarajući oksid. Na primjer, razgradnja kalcijevog karbonata je kako slijedi:
CaCO3 + Q => CaO + CO2
Isto se događa s magnezijevim, stroncijevim i barijevim karbonatima.
Važno je napomenuti da je toplinska razgradnja različita od izgaranja. U prvom nema prisutnosti paljenja ili se oslobađa toplina, dok je u drugom da; to jest, izgaranje je egzotermna reakcija, iako treba početni izvor topline da se dogodi ili da se dogodi spontano.
Amonijev klorid u vodi
Kada se mala količina amonijevog klorida (NH4Cl) otopi u vodi u epruveti, cijev postaje hladnija nego prije. Tijekom ove kemijske reakcije toplina se apsorbira iz okoline.
Natrijev triosulfat
Kada kristali natrijevog tiosulfata (Na2S2O3.5H2O), obično nazvan hypo, otapa se u vodi, dolazi do efekta hlađenja.
Automobilski motori
Izgaranje benzina ili dizela u motorima automobila, kamiona, traktora ili autobusa proizvodi mehaničku energiju koja se koristi u prometu tih vozila..
Kipuće tekućine
Stavljajući tekućinu u toplinu, ona dobiva energiju i odlazi u plinovito stanje.
Kuhanje jaja
Kada se primjenjuje toplina, proteini jaja se denaturiraju, tvoreći čvrstu strukturu koja se obično ingestira.
Kuhanje hrane
Općenito, uvijek kada kuhate s toplinom kako biste promijenili svojstva hrane, pojavljuju se endotermne reakcije.
Ove reakcije su ono što uzrokuje da hrana postane mekša, stvara gipke mase, oslobađa komponente koje sadrže, između ostalog.
Zagrijavanje hrane u mikrovalnoj pećnici
Mikrovalnim zračenjem molekule vode u hrani apsorbiraju energiju, počinju vibrirati i povećavaju temperaturu hrane.
Lijevano staklo
Upijanjem topline staklom njihovi spojevi postaju fleksibilniji, pa se njihov oblik lakše mijenja.
Potrošnja svijeće
Vosak od svijeće se topi kad upija toplinu plamena, mijenjajući svoj oblik.
Čišćenje vrućom vodom
Kada koristite vruću vodu za čišćenje predmeta koji su zamrljani mašću, kao što su lonci ili odjeća, masnoća postaje sve tekuća i lakše se uklanja.
Toplinska sterilizacija hrane i drugih predmeta
Kod zagrijavanja predmeta ili hrane, mikroorganizmi koje sadrže također povećavaju temperaturu.
Kada se isporučuje mnogo topline, javljaju se reakcije unutar mikrobnih stanica. Mnoge od tih reakcija, kao što su lomljenje veza ili denaturacija proteina, završavaju ubijanjem mikroorganizama.
Borba protiv infekcija s vrućicom
Kada se groznica manifestira, to je zato što tijelo proizvodi potrebnu toplinu da ubije bakterije i viruse koji uzrokuju infekcije i generiraju bolesti.
Ako je proizvedena toplina visoka, a vrućica visoka, stanice tijela su također pogođene i postoji rizik od smrti.
Isparavanje vode
Kada voda ispari i pretvori se u paru, to je zbog topline koju dobiva iz okoline. Kako toplinska energija dobiva svaka molekula vode, njezina vibracijska energija raste do točke u kojoj se može slobodno kretati, stvarajući isparenja.
reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izdanje). CENGAGE Učenje.
- Wikipedia. (2018.). Endotermički proces. Preuzeto s: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27. prosinca 2018.) Primjeri endotermne reakcije. Preuzeto s: thoughtco.com
- Khan Akademija. (2019). Endotermički nasuprot egzotermne reakcije Preuzeto s: khanacademy.org
- Serm Murmson. (2019). Što se događa na molekularnoj razini tijekom endotermne reakcije? Hearst Seattle Media. Preuzeto s: education.seattlepi.com
- QuimiTube. (2013). Izračunavanje entalpije reakcije iz entalpija formacije. Preuzeto s: quimitube.com
- Quimicas.net (2018). Primjeri endotermne reakcije. Preuzeto iz:
quimicas.net.


