Organske soli fizikalna i kemijska svojstva, primjene i primjeri
organske soli oni su gust broj ionskih spojeva s nebrojenim svojstvima. Oni prethodno proizlaze iz organskog spoja, koji je prošao transformaciju koja mu omogućuje da bude nositelj naboja, a to također, njezin kemijski identitet ovisi o pridruženom ionu..
Na slici ispod prikazane su dvije vrlo općenite kemijske formule za organske soli. Prvi, R-AX, tumači se kao spoj u čijoj ugljikovoj strukturi atom, ili skupina A, nosi pozitivni naboj + ili negativan (-).
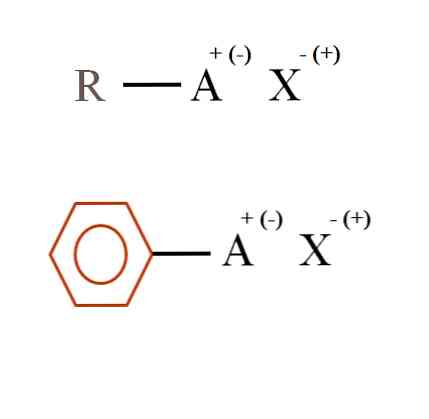
Kao što se vidi, postoji kovalentna veza između R i A, R-A, ali s druge strane, A formalno naboj koji privlači (ili odbija) iona X. Znak naplate ovisiti o prirodi A, i kemijskom okolišu.
Ako je A pozitivna, s koliko X može biti u interakciji? Sa samo jednim, s obzirom na načelo elektroneutralnosti (+ 1-1 = 0). Međutim, koji je identitet X? Anion X može biti CO32-, koji zahtijevaju dva kationa RA+; halogenid: F-, cl-, br-, itd .; ili čak još jedan RA spoj-. Opcije su neprocjenjive.
Također, organska sol može imati aromatski karakter, ilustrirana u smeđem benzenskom prstenu. Sol benzoata bakra (II), (C6H5COO)2Cu se, na primjer, sastoji od dva aromatska prstena s negativno nabijenim karboksilnim skupinama, koji međusobno djeluju s Cu kationom.2+.
indeks
- 1 Fizikalna i kemijska svojstva
- 1.1 Visoke molekularne mase
- 1.2 Amfifili i površinski aktivne tvari
- 1.3 Točke vrenja ili tališta
- 1.4 Kiselost i bazičnost
- 2 Upotreba
- Primjeri organskih soli
- 3.1 Karboksilati
- 3.2 Litijev diakriluprati
- 3.3 Soli sulfonija
- 3.4 Soli oksona
- 3.5 Soli amina
- 3.6 Diazonijeve soli
- 4 Reference
Fizikalna i kemijska svojstva
Iz slike se može reći da se organske soli sastoje od tri komponente: organske, R ili Ar (aromatski prsten), atoma ili skupine koje nose ionski naboj A, i protuiona X.
Kao što su kemijski identitet i struktura definirani takvim komponentama, tako i njihova svojstva ovise o njima.
Iz ove se činjenice mogu sažeti određena opća svojstva koja zadovoljavaju veliku većinu ovih soli.
Visoke molekularne mase
Uz pretpostavku mono ili polivalentnih anorganskih X aniona, organske soli obično imaju mnogo veće molekularne mase od anorganskih soli. To je uglavnom zbog ugljičnog skeleta, čije jednostavne C-C veze, i njihovi atomi vodika, doprinose mnogo mase spoju.
Stoga su R ili Ar odgovorni za svoje visoke molekularne težine.
Amfifili i surfaktanti
Organske soli su amfifilni spojevi, tj. Njihove strukture imaju i hidrofilne i hidrofobne krajeve.
Koje su to krajnosti? R ili Ar predstavljaju hidrofobni kraj, jer njihovi C i H atomi nemaju veliki afinitet za molekule vode.
+(-), atom ili grupa koja nosi naboje je hidrofilni kraj, budući da doprinosi dipolarnom trenutku i stupa u interakciju s dipolima koji tvore vodu (RA)+ OH2).
Kada su hidrofilna i hidrofobna područja polarizirana, amfifilna sol postaje površinski aktivna tvar, tvar koja se široko koristi za proizvodnju deterdženata i deemulgatori.
Točke visokog vrenja ili tališta
Kao i anorganske soli, organske soli također imaju visoke točke taljenja i vrenja, zbog elektrostatskih sila koje vladaju u tekućoj ili čvrstoj fazi.
Međutim, s organskom komponentom R ili Ar, drugi tipovi Van der Waalsovih sila (Londonske sile, dipol-dipol, vodikovi mostovi) koji se natječu na određeni način s elektrostatičkim.
Zbog toga su krute ili tekuće strukture organskih soli u prvom redu složenije i raznovrsnije. Neki od njih se čak mogu i ponašati tekući kristali.
Kiselost i bazičnost
Organske soli su obično jače kiseline ili baze nego anorganske soli. To je zbog toga što A, na primjer u aminskim solima, ima pozitivan naboj zbog svoje veze s dodatnim vodikom: A+-H. Zatim, u kontaktu s bazom, donirajte proton da se vrati kao neutralni spoj:
RA+H + B => RA + HB
H pripada A, ali je napisan kako intervenira u reakciji neutralizacije.
S druge strane, RA+ on može biti velika molekula, nesposobna da formira krutinu sa kristalnom mrežom dovoljno stabilnom s hidroksil anionom ili hidroksilnom OH-.
Kada je to slučaj, sol RA+OH- ponaša se kao snažna baza; čak i osnovni kao NaOH ili KOH:
RA+OH- + HCl => RACl + H2O
U kemijskoj jednadžbi zamijetite Cl anion- zamjenjuje OH-, tvoreći sol RA+cl-.
aplikacije
Upotreba organskih soli će varirati ovisno o identitetu R, Ar, A i X. Nadalje, primjena na koju su namijenjeni ovisi io tipu krutine ili tekućine koju tvore. Neke općenitosti u tom pogledu su:
-Oni služe kao reagensi za sintezu drugih organskih spojeva. RAX može djelovati kao "donor" R lanca koji se dodaje drugom spoju koji zamjenjuje dobru izlaznu skupinu.
-Oni su tenzidi, pa se mogu koristiti i kao lubrikanti. Metalne soli karboksilata koriste se u tu svrhu.
-Oni omogućuju sintezu širokog raspona boja.
Primjeri organskih soli
karboksilati
Karboksilne kiseline reagiraju s hidroksidom u reakciji neutralizacije, što dovodi do nastanka soli karboksilata: RCOO- M+; gdje M+ To može biti bilo koji metalni kation (Na+, Pb2+, K+, itd.) ili NH amonijevog kationa4+.
Masne kiseline su alifatske karboksilne kiseline dugog lanca, mogu biti zasićene i nezasićene. Palmitinska kiselina (CH) je među zasićenim3(CH2)14COOH). To potiče od palmitatne soli, dok stearinska kiselina (CH3(CH2)16COOH tvori sol stearata. Sapuni se sastoje od tih soli.
U slučaju benzojeve kiseline, C6H5COOH (gdje C6H5- to je benzenski prsten) kada reagira s bazom formira benzoat soli. U svim karboksilatima, -COO skupina- predstavlja A (RAX).
Litij diakupuprates
Litijev diakuprat je koristan u organskoj sintezi. Njegova formula je [R-Cu-R]-li+, u kojoj atom bakra nosi negativni naboj. Ovdje bakar predstavlja atom A slike.
Sulfonijeve soli
Oni nastaju reakcijom organskog sulfida s alkil halidom:
R2S + R'X => R2R'S+X
Za te soli, atom sumpora nosi pozitivan formalni naboj (S+) s tri kovalentne veze.
Oksonijeve soli
Također, eteri (oksidirani analozi sulfida) reagiraju s hidrokidima kako bi nastali oksonijeve soli:
ROR '+ HBr <=> RO+HR '+ Br-
Kiselinski proton HBr je kovalentno vezan na atom kisika etera (R2O+-H), stavljajući ga pozitivno.
Soli amina
Amini mogu biti primarni, sekundarni, tercijarni ili kvarterni, kao i njihove soli. Svi oni su karakterizirani time da imaju H atom vezan na atom dušika.
Dakle, RNH3+X- to je primarna sol amina; R2NH2+X-, sekundarnog amina; R3NH+X-, tercijarnog amina; i R4N+X-, kvaternarnog amina (kvaterna amonijeva sol).
Diazonijeve soli
Konačno, diazonijeve soli (RN2+X-) ili arildiazonij (ArN)2+X-), predstavljaju polaznu točku za mnoge organske spojeve, osobito azo boje.
reference
- Francis A. Carey. Organska kemija (Sixth edition., Str. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organska kemija. Amini. (10. izdanje.). Wiley Plus.
- Wikipedia. (2018.). Sol (Kemija). Preuzeto s: en.wikipedia.org
- Steven A. Hardinger. (2017). Ilustrirani rječnik pojmova organska kemija: soli. Preuzeto s: chem.ucla.edu
- Chevron Oronite. (2011). Karboksilati. [PDF]. Preuzeto s: oronite.com


