Osnove, svojstva i nedostaci teorije mora elektrona
elektronska teorija elektrona To je hipoteza koja objašnjava izniman kemijski fenomen koji se pojavljuje u metalnim vezama između elemenata s niskim elektronegativnostima. Radi se o dijeljenju elektrona između različitih atoma povezanih metalnim vezama.
Elektronska gustoća između tih veza je takva da su elektroni delokalizirani i tvore "more" gdje se slobodno kreću. Također se može izraziti kvantnom mehanikom: neki elektroni (obično jedan do sedam po atomu) raspoređeni su u orbitale s višestrukim centrima koji su rastegnuti preko metalne površine.
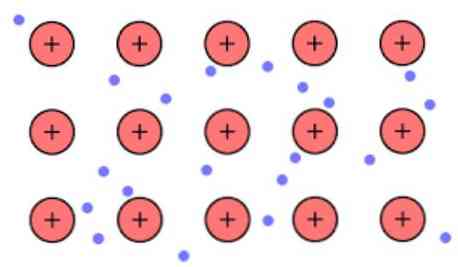
Također, elektroni zadržavaju određeno mjesto u metalu, iako razdioba vjerojatnosti elektroničkog oblaka ima veću gustoću oko nekih specifičnih atoma. To je zbog činjenice da pri primjeni određene struje pokazuju svoju vodljivost u određenom smjeru.
indeks
- 1 Osnove teorije o moru elektrona
- 2 Svojstva
- 2.1 Pomak u obliku slojeva
- 2.2 Teorija mora elektrona u metalnim kristalima
- 3 Nedostaci teorije
- 4 Reference
Osnove teorije o moru elektrona
Metalni elementi imaju veliku tendenciju da doniraju elektrone sa svoje posljednje energetske razine (valentni sloj), zbog njihove niske ionizacijske energije u odnosu na ostale elemente..
Znajući to, svaki se metalni element može smatrati kationom koji je povezan s elektronom njegove posljednje energetske razine, koji bi bio skloniji darivanju.
Budući da u metalu imate veliki broj atoma koji su međusobno povezani, možete pretpostaviti da taj metal formira skupinu metalnih kationa koji su uronjeni u neku vrstu mora valentnih elektrona koji imaju veliko offshoring.
S obzirom da elektrostatičke sile privlačenja koje postoje između kationa (pozitivnog naboja) i elektrona (negativni naboj) imaju snažno povezane atome metala, on zamišlja delokalizaciju valentnih elektrona koji se ponašaju kao elektrostatički adheziv koji zadržava vezu na metalne katione.
Na taj se način može zaključiti da što je veći broj elektrona prisutnih u valentnom sloju metala, takva vrsta elektrostatskog ljepila će imati veću čvrstoću..
nekretnine
Teorija o moru elektrona nudi jednostavno objašnjenje karakteristika metalnih vrsta kao što su otpornost, vodljivost, duktilnost i savitljivost, koje variraju od jednog metala do drugog..
Otkriveno je da se otpornost na metale javlja zbog velike delokalizacije njihovih elektrona, što stvara vrlo visoku kohezijsku silu između atoma koji ga tvore..
Na taj način je duktilnost poznata kao sposobnost određenih materijala da dopuste deformaciju njihove strukture, bez da daju dovoljno da se lome, kada se podvrgnu određenim silama.
Offshoring u obliku slojeva
I duktilnost i savitljivost metala određeni su činjenicom da su valentni elektroni delokalizirani u svim smjerovima u obliku slojeva, što ih uzrokuje da se kreću jedan iznad drugog pod djelovanjem vanjske sile, izbjegavajući lomljenje metalne konstrukcije, ali dopuštajući njegovu deformaciju.
Isto tako, sloboda kretanja delokaliziranih elektrona dopušta da postoji struja električne struje, zbog čega metali imaju vrlo dobru provodljivost električne energije.
Osim toga, ovaj fenomen slobodnog kretanja elektrona omogućuje prijenos kinetičke energije između različitih područja metala, što potiče prijenos topline i uzrokuje da metali ispoljavaju visoku toplinsku vodljivost..
Teorija mora elektrona u metalnim kristalima
Kristali su čvrste tvari koje imaju fizikalna i kemijska svojstva - kao što su gustoća, točka taljenja i tvrdoća - koje se utvrđuju vrstom sila koje čine čestice koje ih drže zajedno.
Na neki način, smatra se da kristali metalnog tipa imaju najjednostavnije strukture, jer je svaka "točka" kristalne mreže zauzeta atomom samog metala..
U tom istom smislu, utvrđeno je da je struktura metalnih kristala općenito kubična i fokusira se na lica ili tijelo.
Međutim, ove vrste također mogu biti šesterokutnog oblika i imati prilično kompaktno pakiranje, što im daje da je ogromna gustoća koja je karakteristična.
Zbog tog strukturalnog razloga, veze koje nastaju u metalnim kristalima razlikuju se od onih koje se javljaju u drugim vrstama kristala. Elektroni koji mogu tvoriti veze su delokalizirani kroz kristalnu strukturu, kao što je gore objašnjeno.
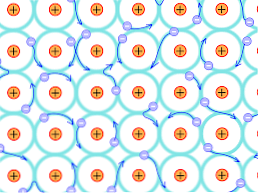
Nedostaci teorije
U metalnim atomima postoji mala količina valentnih elektrona proporcionalno njihovim energetskim razinama; to jest, postoji veća količina dostupnih energetskih stanja od količine povezanih elektrona.
To podrazumijeva da, budući da postoji jaka elektronička delokalizacija i također djelomično ispunjene energetske trake, elektroni se mogu kretati kroz retikularnu strukturu kada su podvrgnuti električnom polju koje dolazi izvana, uz formiranje oceana elektrona. koji podržava propusnost mreže.
Tako se unija metala interpretira kao konglomerat pozitivno nabijenih iona spojenih morem elektrona (negativno nabijenim).
Međutim, postoje karakteristike koje se ne objašnjavaju ovim modelom, kao što je formiranje određenih legura između metala sa specifičnim sastavima ili stabilnost kolektivnih metalnih veza, između ostalih..
Te nedostatke objašnjava kvantna mehanika, jer su i ova teorija i mnogi drugi pristupi utemeljeni na najjednostavnijem modelu jednog elektrona, dok se pokušava primijeniti mnogo složenije strukture multielektronskih atoma..
reference
- Wikipedia. (2018.). Wikipedia. Preuzeto s en.wikipedia.org
- Holman, J.S. i Stone, P. (2001). Kemija. Preuzeto s books.google.co.ve
- Parkin, G. (2010). Lijepljenje metala i metala. Preuzeto s books.google.co.ve
- Rohrer, G.S. (2001). Struktura i lijepljenje u kristalnim materijalima. Preuzeto s books.google.co.ve
- Ibach, H., i Lüth, H. (2009). Fizika čvrstog stanja: uvod u principe znanosti o materijalima. Preuzeto s books.google.co.ve


