Struktura, svojstva i uporaba Berilijevog oksida (BeO)
berilijev oksid (BeO) je keramički materijal koji, uz visoku čvrstoću i električnu otpornost, ima visoki kapacitet provođenja topline, što ga čini dijelom nuklearnih reaktora, nadilazeći čak i metale u ovom posljednjem svojstvu..
Osim što je korisna kao sintetički materijal, može se naći iu prirodi, iako je rijetka. Njezino upravljanje mora se provoditi oprezno, jer ima sposobnost ozbiljnog oštećenja zdravlja ljudi.
U suvremenom svijetu, uočeno je kako su znanstvenici povezani s tehnološkim tvrtkama proveli istraživanje kako bi razvili napredne materijale za vrlo specijalizirane aplikacije, kao što su one koje su u skladu s poluvodičkim materijalima i onima u zrakoplovnoj industriji..
Rezultat toga bio je otkriće tvari koje su nam, zahvaljujući svojim iznimno korisnim svojstvima i visokoj izdržljivosti, pružile priliku za napredak u vremenu, dopuštajući nam da svoju tehnologiju prenesemo na više razine..
indeks
- 1 Kemijska struktura
- 2 Svojstva
- 2.1 Električna vodljivost
- 2.2 Toplinska provodljivost
- 2.3 Optička svojstva
- 2.4 Zdravstveni rizici
- 3 Upotreba
- 3.1 Elektroničke aplikacije
- 3.2 Nuklearne primjene
- 3.3 Ostale aplikacije
- 4 Reference
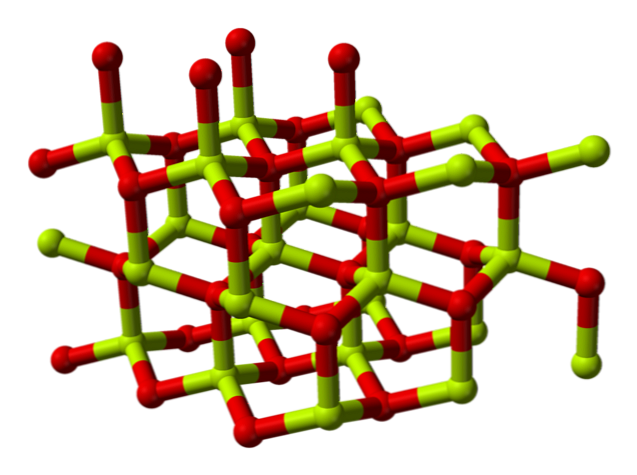
Kemijska struktura
Molekula berilij oksida (također se naziva "Beryllia") Sastoji se od atoma berilija i atoma kisika, koji su koordinirani u tetraedarskoj orijentaciji i kristalizira se u heksagonalnim kristalnim strukturama zvanim wurtzites.
Ti kristali imaju tetraedarske centre, koje zauzima Be2+ i O2-. Na visokim temperaturama struktura berilijevog oksida postaje tetragonalna.
Dobivanje berilijevog oksida postiže se trima metodama: kalcinacija berilijevog karbonata, dehidracija berilijevog hidroksida ili paljenje berilijevog metala. Berilijev oksid nastao na visokim temperaturama je inertan, ali se može otopiti u nekoliko spojeva.
Beco3 + Toplina → BeO + CO2 (Kalciniranje)
Be (OH)2 → BeO + H2O (dehidracija)
2 Be + O2 → 2 BeO (paljenje)
Konačno, berilijev oksid može se ispariti, te će se u tom stanju prikazati u obliku dvoatomskih molekula..
nekretnine
Berilijev oksid u prirodi se javlja kao bromelit, bijeli mineral koji se nalazi u nekim složenim naslagama manganovog željeza, ali se češće nalazi u njegovom sintetičkom obliku: bijela amorfna krutina koja se proizvodi u obliku praška..
Također, nečistoće koje su zarobljene tijekom proizvodnje daju različite boje uzorku oksida.
Točka tališta je 2507 ° C, vrelište je 3900 ° C, a gustoća je 3,01 g / cm.3.
Na isti način, njegova kemijska stabilnost je znatno visoka, samo reagira s vodenom parom na temperaturama blizu 1000 ° C, i može odoljeti procesima redukcije ugljika i napadima rastaljenih metala na visokim temperaturama..
Osim toga, njegova mehanička čvrstoća je pristojna i može se poboljšati s dizajnom i izradom prikladnom za komercijalnu uporabu.
Električna vodljivost
Berilijev oksid je vrlo stabilan keramički materijal i stoga ima prilično visok električni otpor što ga čini jednim od najboljih električnih izolacijskih materijala, zajedno s glinicom.
Zbog toga se ovaj materijal najčešće koristi za specijalizirane visokofrekventne električne uređaje.
Toplinska provodljivost
Berilijev oksid ima veliku prednost u pogledu toplinske provodljivosti: poznat je kao drugi najbolji materijal za provođenje topline među nemetalima, a premašuje ga samo dijamant, materijal znatno skuplji i rijetki..
Što se metala tiče, samo bakar i srebro bolje prenose toplinu nego berilijev oksid, što ga čini vrlo poželjnim materijalom.
Zbog svojih izvrsnih svojstava toplinske provodljivosti, ova tvar je uključena u proizvodnju vatrostalnih materijala.
Optička svojstva
Zbog svojih kristalnih osobina, berilijev oksid se koristi za nanošenje prozirnog materijala na ultraljubičasto zračenje u određenim ravnim zaslonima i fotonaponskim ćelijama.
Isto tako, mogu se proizvesti kristali vrlo visoke kvalitete, tako da se ta svojstva poboljšavaju u skladu s korištenim postupkom proizvodnje.
Zdravstveni rizici
Berilijev oksid je spoj koji se mora postupati s velikom pažnjom, budući da prvo posjeduje karcinogena svojstva, koja su povezana s kontinuiranim udisanjem praha ili para ovog materijala..
Male čestice u ovim fazama oksida prianjaju na pluća i mogu generirati nastanak tumora ili bolest poznatu kao berilioza..
Berilioza je bolest sa srednjom stopom smrtnosti koja uzrokuje neučinkovito disanje, kašalj, gubitak težine i vrućicu, te stvaranje granuloma u plućima ili drugim zahvaćenim organima..
Postoje i opasnosti za zdravlje od izravnog kontakta berilijevog oksida s kožom, jer je nagrizajuće i iritantno, a može uzrokovati oštećenje površine kože i sluznice. Prilikom rada s ovim materijalom, osobito u obliku praha, treba zaštititi dišne puteve i ruke.
aplikacije
Uporaba berilijevog oksida uglavnom se dijeli na tri: elektroničke, nuklearne i druge primjene.
Elektroničke aplikacije
Mogućnost prijenosa topline na visoku razinu i dobra električna otpornost učinili su da berilijev oksid dobije veliku korisnost kao hladnjak.
Njegova uporaba dokazana je u krugovima unutar računala velikog kapaciteta, uz opremu koja rukuje visokim strujama struje.
Berilijev oksid je proziran za rendgenske zrake i mikrovalove, pa se koristi u prozorima protiv ovih vrsta zračenja, kao i antene, komunikacijski sustavi i mikrovalne pećnice..
Nuklearne primjene
Njegova sposobnost da ublažava neutrone i održava strukturu pod bombardiranjem zračenja učinila je berilijev oksid uključenim u izgradnju nuklearnih reaktora, a može se primijeniti iu visokotemperaturnim reaktorima hlađenim plinovima.
Ostale aplikacije
Mala gustoća berilijevog oksida izazvala je zanimanje za zrakoplovnu i vojnu tehnologiju, jer može predstavljati opciju male težine u raketnim motorima i neprobojnim prslucima..
Konačno, nedavno je primijenjen kao vatrostalni materijal u fuziji metala u metalurškoj industriji.
reference
- Pubchem. (N. D.). Berilijev oksid. Preuzeto s pubchem.ncbi.nlm.nih.gov
- Reade. (N. D.). Beryllia / Berilijev oksid (BeO). Oporavio se od reade.com
- Research, C. (s.f.). Berilijev oksid - Berilija. Preuzeto s azom.com
- Services, N.J. (s.f.). Berilijev oksid. Preuzeto s nj.gov
- Wikipedia. (N. D.). Berilijev oksid. Preuzeto s en.wikipedia.org


