Giemsa temelj za bojenje, materijali, tehnika i uporaba
Giemsa mrlja je vrsta bojenja kliničkih uzoraka, zasnovana na mješavini kiselih i bazičnih bojila. Njezino stvaranje inspirirano je radom Romanowskog, gdje ga je Gustav Giemsa, kemičar i bakteriolog podrijetlom iz Njemačke, usavršio dodavanjem glicerola za stabilizaciju spojeva..
Promjene nastale u originalnoj tehnici Romanowskog omogućile su znatno poboljšanje mikroskopskih opažanja, stoga je tehnika krštena imenom Giemsa mrlja.
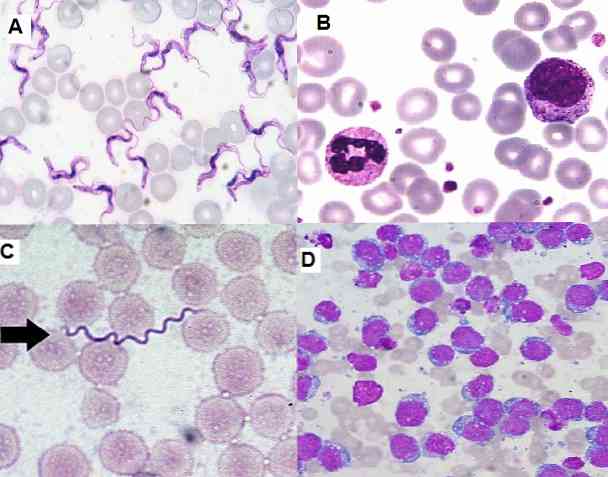
Budući da je to jednostavna tehnika za izvođenje, vrlo funkcionalna i ekonomična, trenutno se široko koristi u kliničkom laboratoriju za hematološke mrlje, uzorke koštane srži i sekcije tkiva..
Giemsa tehnika bojanja vrlo je korisna za citološke studije, jer omogućuje promatranje specifičnih struktura stanica. Ova tehnika boji citoplazme, jezgre, jezgre, vakuole i granule stanica, te može razlikovati čak i fine tragove kromatina.
Osim toga, mogu se otkriti značajne promjene u veličini, obliku ili obojenosti jezgre, gdje je moguće vizualizirati gubitak odnosa nukleus-citoplazma..
S druge strane, omogućuje identificiranje nezrelih stanica u koštanoj srži i perifernoj krvi, što je važno za dijagnosticiranje ozbiljnih bolesti kao što je leukemija. Također je moguće detektirati hemoparazite, ekstra i intracelularne bakterije, gljivice, među ostalima.
U citogenetici se vrlo dobro koristi, budući da je moguće proučavati mitozu stanica.
indeks
- 1 Utemeljenje Giemsine boje
- 2 Materijali
- 2.1 Materijali za pripremu matične otopine
- 2.2 Način pripreme matične otopine
- 2.3 Materijali za pripremu puferske otopine
- 2.4 Završna priprema boje
- 2.5 Dodatni materijali potrebni za bojanje
- 3 Tehnika
- 3.1 Proces bojenja
- 4 Uslužni programi
- 4.1 Hematologija
- 4.2 Mikologija
- 4.3. Bakteriologija
- 4.4 Parazitologija
- 4.5 Citologija
- 4.6 Citogenetika
- 5 Istraživanje koje pokazuje učinkovitost Giemsa bojenja
- 6 Preporuke za dobro bojenje
- 7 Uobičajene pogreške u bojanju Giemse
- 7.1 Izuzetno plava boja
- 7.2. Prekomjerno ružičasta boja
- 7.3 Prisustvo taloga u razmazu
- 7.4. Prisutnost morfoloških artefakata
- 8 Način pohrane
- 9 Reference
Utemeljenje Giemsine boje
Boje tipa Romanowsky temelje se na upotrebi kontrasta između kiselih i baznih bojila, kako bi se postiglo bojenje osnovnih i kiselih struktura. Kao što se može vidjeti, afinitet kiselih boja je da oboje osnovne strukture i obrnuto.
Osnovna boja koja se koristi je metilensko plavo i njegovi oksidirani derivati (Azure A i Azure B), dok je kiselinska boja eozin.
Kisele strukture stanica su nukleinske kiseline, granule segmentiranih bazofila, među ostalima, stoga će biti obojene metilensko plavom bojom..
U tom istom smislu, osnovne strukture stanica su hemoglobin i neke granule kao što su one sadržane u segmentiranim eozinofilima, između ostalih; one će biti obojene eozinom.
S druge strane, zbog činjenice da su metilensko plavo i azurno obilježene metakromatskim bojama, one mogu pružiti varijabilni ton različitim strukturama u skladu s opterećenjem polianiona koje posjeduju..
Na taj način strateška kombinacija osnovnih i kiselih boja može razviti širok spektar boja, prema biokemijskim karakteristikama svake strukture, hodajući kroz blijedoplave, tamno plave, jorgovane i ljubičaste tonove u slučaju kiselih struktura.
Dok je obojenost koju pruža eozin stabilnija, stvaraju se boje između crvenkasto-narančaste i lososove boje.
materijali
Materijali za pripremu matične otopine
Priprema temeljne otopine zahtijeva vaganje 600 mg praha Giemsa boje, mjerenje 500 cc metilnog alkohola bez acetona i 50 cm3 neutralnog glicerina.
Način pripreme matične otopine
Stavite teški prašak Giemsa u žbuku. Ako postoje kvržice, treba ih poprskati. Nakon toga dodajte znatnu količinu izmjerenog glicerina i dobro promiješajte. Dobivena smjesa se ulije u vrlo čistu jantarnu bocu.
Ostatak glicerina stavlja se u mort. Ponovno promiješajte kako biste očistili preostalu boju koja je zalijepljena za zidove morta i ulijte u istu bocu.
Boca je pokrivena i nosena 2 sata u vodenoj kupelji na 55 ° C. Dok ste u kupki s vodenom kupkom, lagano promiješajte smjesu svakih pola sata.
Nakon toga, smjesa se ostavi da se ohladi da se stavi alkohol. Prethodno je dio izmjerenog alkohola stavljen u mort kako bi se završilo pranje onoga što je ostalo od boje, a zatim je dodano u smjesu zajedno s ostatkom alkohola..
Ovaj pripravak treba ostaviti da sazrijeva najmanje 2 tjedna. Dio koji se koristi za majčinu otopinu mora se filtrirati.
Da bi se izbjegla kontaminacija preparata, preporuča se proći dio koji će biti u stalnoj uporabi u maloj jantarnoj bočici s kapaljkom. Napunite svaki put kad se reagens ponestane.
Materijali za pripremu otopine pufera
S druge strane, pufer otopina na pH 7.2 je pripravljena kako slijedi:
Izvaže se 6,77 g natrijevog fosfata (bezvodnog) (NaHPO4), 2,59 g kalijevog dihidrogen fosfata (KH)2PO4) i destilirana voda do 1000 cm3.
Konačna priprema boje
Za pripravu konačne otopine za bojenje, izmjerena je 2 cc filtrirane stočne otopine i pomiješana sa 6 cm3 otopine pufera. Smjesa se miješa.
Relevantna činjenica koja se mora uzeti u obzir je da se tehnike pripreme boje mogu promijeniti u skladu s komercijalnom kućom.
Dodatni materijali potrebni za bojanje
Osim opisanih materijala, treba imati mostove u boji, vodene zaslone ili odbojnike za pranje, listove za predmete ili poklopce, štopericu za kontrolu vremena bojanja i upijajući papir ili neki materijal koji se može koristiti za sušenje ( gaza ili pamuk).
tehnika
Postupak bojenja
1) Prije bojenja, uzorak se mora proširiti na čistu pločicu..
Uzorci mogu biti krv, koštana srž, rezovi histoloških tkiva ili cerviko-vaginalni uzorci. Preporučuje se da vanjski slojevi budu tanki i imaju 1 ili 2 sata sušenja prije bojenja.
2) Svi listovi koje morate obojiti postavljeni su na obojenom mostu. Uvijek radite istim redoslijedom i dobro označite svaki list.
3) Stavite nekoliko kapi 100% metilnog alkohola (metanola) na razmaz i ostavite 3 do 5 minuta, kako bi se uzorak fiksirao i dehidrirao.
4) Bacite metanol prisutan u listu i ostavite da se osuši na zraku.
5) Nakon sušenja, stavite konačnu otopinu za bojenje s kapaljkom dok se ne pokrije cijeli list. Ostavite 15 minuta. Neki autori preporučuju do 25 minuta. Ovisi o komercijalnoj kući.
6) Ocijedite boju i isperite razmaz destiliranom vodom ili s 7.2 pufer otopinom.
7) Na upijajućem papiru ostavite da se listovi suše na otvorenom, postavljeni okomito uz pomoć nosača.
8) Obrišite stražnju stranu klizača gazom ili pamučnom krpom namočenom u alkohol kako biste uklonili preostalu boju.
komunalne usluge
Tehnika bojenja Giemsa koristi se u nekoliko područja, uključujući: hematologiju, mikologiju, bakteriologiju, parazitologiju, citologiju i citogenetiku..
hematološki
To je najčešća korisnost koja se daje ovom bojanju. Uz to, možemo identificirati svaku i svaku od stanica prisutnih u uzorcima koštane srži ili periferne krvi. Kao i procjena broja svake serije, mogućnost detekcije leukocitoze ili leukopenije, trombocitopenije itd..
Budući da je osjetljiva na identifikaciju nezrelih stanica, ona je relevantna u dijagnostici akutnih ili kroničnih leukemija. Također je moguće dijagnosticirati anemiju, poput bolesti srpastih stanica, bolesti srpastih stanica, među ostalima..
mikologija
U ovom području uobičajeno je da se koristi za traženje Histoplasma capsulatum (intracelularna dimorfna gljivica) u uzorcima tkiva.
bakteriologija
Kod hematoloških razmaza obojenih Giemsom moguće je detektirati Borrelias sp u bolesnika koji imaju bolest koja se zove recurrentis groznice. Spirohete obiluju eritrocitima, u uzorcima uzetim na febrilnom vrhu.
Također je moguće vizualizirati unutarstanične bakterije kao Rickettsias sp i Chlamydia trachomatis u zaraženim stanicama.
parazitologija
U području parazitologije, Giemsa bojenje je omogućilo dijagnosticiranje parazitskih bolesti kao što su malarija, Chagasova bolest i leishmanijaza..
U prva dva parazita Plasmodium sp i Trypanosoma cruzi odnosno mogu se vizualizirati u perifernoj krvi zaraženih pacijenata, a mogu se naći u različitim fazama u skladu s fazom u kojoj je bolest.
Da bi se poboljšala potraga za krvnim parazitima, preporuča se koristiti Giemsa mrlju pomiješanu s bojom May-Grünwald.
Isto tako, kožni lišmanijaza se može dijagnosticirati kada se procjenjuju uzorci biopsija kože obojanih Giemsom, gdje se pronalazi parazit..
citologija
Giemsa bojenje također se koristi za citološka ispitivanja endocervikalnih uzoraka, iako to nije najčešće korištena tehnika u tu svrhu..
No, u slučajevima oskudice resursa može se koristiti, ima funkcionalnost sličnu onoj koju nudi Papanicolaou tehnika i po nižoj cijeni. Međutim, to zahtijeva stručnost ispitivača.
citogenetika
Značajno obilježje bojanja Giemsa je njegova sposobnost da se snažno veže na područja bogata DNK adeninima i timinima. To omogućuje da se DNA vizualizira tijekom mitoze stanica, u različitim stanjima kondenzacije.
Ove studije su neophodne za otkrivanje kromatskih aberacija kao što su duplikacije, delecije ili translokacije različitih regija kromosoma..
Istraživanja pokazuju učinkovitost Giemsa bojenja
Cannova i sur. (2016) uspoređivali su 3 tehnike bojanja za dijagnozu kožnog lišmanijaze.
Za to su koristili uzorke dobivene od eksperimentalne životinje (Mesocrisetus auratus) eksperimentalno inokuliran s Leishmanias.
Autori su pokazali da je bojanje Giemsa bilo bolje od Pap-mart® i Gaffney boje. Stoga su smatrali da je Giemsa mrlja idealna za dijagnosticiranje kožnog lišmanijaze.
Izvrsni rezultati dobiveni od strane autora rezultat su činjenice da kombinacija boja koje čine Giemsa smjesu predstavljaju potrebne uvjete za stvaranje povoljnog kontrasta, omogućujući jasno razlikovanje amastigotnih struktura, i unutar i izvanstanično..
Druge tehnike (Pap-mart® i Gaffney) također su to učinile, ali na slabiji način i stoga teže vizualizirati. Zbog toga se Giemsa mrlja preporučuje za parazitološku dijagnostiku lišmanijaze.
Isto tako, studija koju je proveo Ramírez et al (1994), procijenila je valjanost Giemsa i Lendrum mrlja u konjuktivalnim razmazima za identifikaciju Chlamydia trachomatis.
Autori su utvrdili da Giemsa i Ledrum bojanje imaju istu specifičnost, ali Giemsa je bila osjetljivija.
To objašnjava zašto se Giemsa bojanje najčešće koristi za dijagnosticiranje klamidijskih infekcija, osobito ako postoji malo resursa.
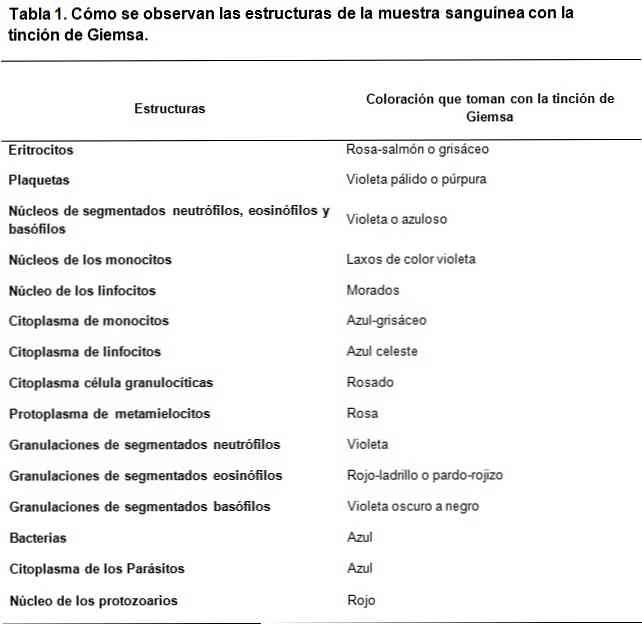
Preporuke za dobro bojenje
Sušenje ploča ne bi trebalo ubrzati. Prudentno vrijeme mora se čekati na sušenje na otvorenom. Otprilike 2 sata.
Boje odmah nakon 2 sata za najbolje rezultate.
Da bi se brisevi bolje fiksirali i obojili, uzorak se mora rasporediti na list tako da ostane tanak i ujednačen sloj..
Poželjni uzorak krvi je kapilara, budući da se razmaz vrši izravno iz kapi krvi i stoga uzorak nema aditiva, što pogoduje održavanju staničnih struktura..
Međutim, ako se upotrebljava venska krv, EDTA treba koristiti kao antikoagulant, a ne heparin, budući da posljednji obično deformira stanice..
Uobičajene pogreške u bojanju Giemse
U praksi ovog bojanja mogu se napraviti pogreške. O njima svjedoče nagle promjene u nijansama struktura.
Izuzetno plava boja
Može biti zbog:
- Vrlo guste mrlje
- Prekoračenje vremena bojenja
- Premalo pranje.
- Korištenje reagensa znatno iznad neutralnog pH (alkalna).
Pod tim uvjetima boje sljedećih struktura su iskrivljene, tako da će eritrociti umjesto umirući ružičasto-losos izgledati zeleno, granule eozinofila koje treba obojiti crvenom ciglom postat će plave ili sive i tako dalje. odstupanja u uobičajenim tonalitetima.
Pretjerano ružičasta boja
Može biti zbog:
- Nedovoljno vrijeme bojenja.
- Dugotrajno ili pretjerano pranje.
- Loše sušenje.
- Upotreba vrlo kiselih reagensa.
U ovom konkretnom slučaju, strukture koje su normalno obojene plave boje neće biti gotovo vidljive, dok će strukture koje su obojene ružičastom bojom imati vrlo pretjerane tonalitete..
Primjer: eritrociti će poprimiti jarko crvenu ili jaku narančastu boju, nuklearni kromatin će izgledati blijedo ružičast i granule eozinofila postat će jarko crvene..
Prisutnost taloga u razmazu
Uzroci mogu biti:
- Koristite prljave ili slabo isprane listove.
- Nemojte dopustiti da se bris dobro suši.
- Ostavite rješenje za fiksiranje predugo.
- Neadekvatno pranje na kraju bojenja.
- Neodgovarajuća filtracija ili nefiltracija boje koja se koristi.
Prisutnost morfoloških artefakata
Morfološki artefakti mogu se pojaviti u razmazima, što otežava vizualizaciju i interpretaciju prisutnih struktura. To je zbog:
- Vrsta upotrijebljenog antikoagulanta, kao što je heparin.
- Upotreba prljavih, oštećenih ili masnih listova.
Način pohrane
Nakon pripreme boja treba čuvati na sobnoj temperaturi (15 - 25 ° C), kako bi se spriječilo taloženje boje. Mora se čuvati u zatvorenom spremniku od jantara.
reference
- Cannova D, Brito E i Simons M. Procjena tehnika bojanja za dijagnozu kožnog lišmanijaze. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW reagensi. Giemsa mrlja. Verzija 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Španjolska.
- Clark G. Postupci bojenja (1981), 4-db. Williams & Willkins.
- Primijenjena klinička kemija Giemsa boja za dijagnozu in vitro. Distributer: cromakit.es
- Ramírez I, Mejía M, Garcia de la Riva J, Hermes F i Grazioso C. Valjanost mrlja Giemsa i Lendrum u konjuktivalnim razmazima za identifikaciju Chlamydia trachomatis. Bol od Sanit Panama. 1994; 116 (3): 212-216.
- Casas-Rincon G. Opća mikologija. 1994. 2. izdanje Universidad Central de Venezuela, Knjižnična izdanja. Venecuela, Caracas.
- "Gemsa mrlja." Wikipedija, slobodna enciklopedija. 1. ruj 2017., 01:02 UTC. 6. prosinca 2018., en.wikipedia.org.


