Kinyoun temelj za bojenje i tehnike
Kinyoun bojenje To je tehnika bojanja koja se koristi za bojenje bakterija i kiselih parazita. Nastao je iz modifikacije bojanja Ziehl-Neelsena; Obje tehnike tumače se na isti način, ali se razlikuju u dva elementa: u pripremi glavnog reagensa iu tome da Kinyoun tehnika ne koristi toplinu.
Zbog toga je također poznat kao hladno modificirano Ziehl-Neelsen ili Kinyoun hladno bojenje. Pokazuje se za bojanje Mycobacterium tuberculosis, Mycobacterium leprae, atipične mikobakterije, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris i Cyclosporas cayetanensis.
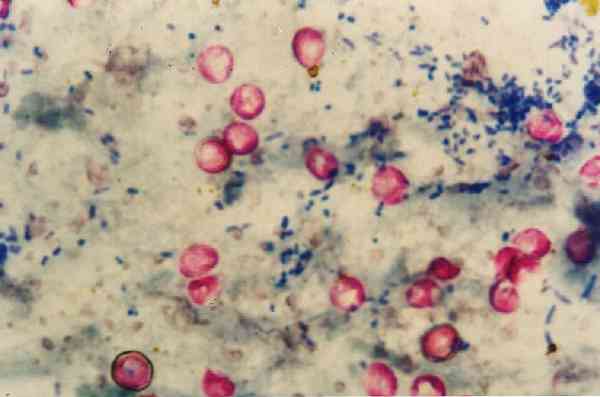
Važno je napomenuti da Nocardias slabo oslikava ovu tehniku jer su djelomično alkoholom otporni na kiseline, pa za ovaj žanr postoji modifikacija metodologije..
S druge strane, Kinyoun hladna tehnika kombinirana je s tehnikom trihroma koju je Didier modificirao za otkrivanje kokcidija (Cryptosporidium parvum i Isospora belli) i spore mikrosporidije (Enterocytozoon bieneusi i Encephalitozoon intestinalis).
indeks
- 1 Temelj
- 2 Tehnika
- 2.1 Materijali
- 2.2 Priprema kinyoun fenicated fuksina
- 2.3 Priprema alkoholne kiseline
- 2.4 Priprema metilensko-plavog kontrastnog bojila
- 2.5 Tehnika kinyoun boje
- 2.6. Posebna tehnika kinyoun-a za nocardije
- 2.7 Kombinirana tehnika fenolnog i trikromnog fuksina modificiranog po Didieru
- 2.8 Kontrola kvalitete
- 3 Kinyoun tehnika u usporedbi sa Ziehl tehnikom -Neelsen
- 4 Reference
temelj
Glavni reagens za bojenje je carbol fuchsin ili fuchsin fenicada, koji ima svojstvo vezanja na karbolne kiseline koje postoje unutar voštane stanične stijenke, bogate lipidima (mikoličkim kiselinama) mikobakterija i određenih parazita..
Taj spoj nije suzbijen uklanjanjem kiseline; prema tome, mikroorganizmi su definirani kao alkohol otporan na kiselinu.
Za razliku od tehnike Ziehl-Neelsen - koja fiksira boju kroz toplinu - u Kinyoun tehnici ovaj korak nije potreban, jer fenolna otopina fuksina pripremljena za ovu tehniku sadrži visoku koncentraciju fenola..
Fenol otapa lipidni materijal stanične stijenke, što omogućuje ulaz karbol fuchsin boje. Nakon što boja prodre, ostaje fiksirana unatoč ispiranju s alkoholnom kiselinom.
Na taj način, mikroorganizmi otporni na kiselinu poprimaju karakterističnu crvenu boju, dok sve što nije alkoholno otporan alkohol postaje obojen i obojen u plavo..
tehnika
materijali
- Modificirani fenolni fuksin.
- alkohol octene.
- Metilensko plavo.
Priprema kinyoun fenicated fuchsin
- Osnovni fuksin: 4 gr.
- Fenol: 8 ml.
- Alkohol (95%): 20 ml.
- Destilirana voda: 100 ml.
Osnovni fuksin u alkoholu mora se polako rastopiti, stalno miješati. Zatim se kristalizirani fenol tali u vodenoj kupelji na 56 ° C. Kada se otopi, dodajte 8 ml gore navedenoj otopini fuksina.
Priprema alkoholne kiseline
- Koncentrirana klorovodična kiselina: 3 ml.
- Etanol (95%): 97 ml.
Mora se mjeriti, spajati i miješati.
Priprema kontrastne boje metilenskog plava
- Metilensko plavo: 0,3 g.
- Destilirana voda: 100 ml.
Izvagano je i otopljeno.
Kinyoun tehnika mrlja
1- Pripremite razmaz izravno iz uzorka, koji može biti sputum, plućna tekućina, sediment urina, cerebrospinalna tekućina ili izmet, među ostalima; ili iz suspenzije mikroorganizama dobivenih iz čistih kolonija razvijenih u primarnom mediju za kulturu.
2. Popravite razmaz toplinom.
3. Stavite mrlju na most za bojanje i pokrijte pripremljenim reagensom Kinyoun fenolnog fuksina. Neka sjedi 3 ili 5 minuta.
4. Isperite destiliranom vodom.
5 Bjelilo s kiselim alkoholom 3 minute i ponovno isprati destiliranom vodom.
6. Ponovno izbijelite s kiselim alkoholom 1 ili 2 minute dok se više ne uvlači boja.
7. Isperite destiliranom vodom i pustite da se slivnik postavi u uspravan položaj.
8. Pokrijte preparat metilenskim plavim i ostavite 4 minute.
9- Operite destiliranom vodom i osušite.
10. Ispitajte na 40X, a zatim na 100X.
Ako želite poboljšati i ubrzati bojenje mikroorganizama koji se nalaze u kiselom stanju, dodajte 1 kap agenta za vlaženje (kao što je tergitol br. 7) u 30 ili 40 ml Kinyoun-ovog fenolnog fuksina..
Neki laboratoriji mijenjaju boju metilenskog plavog kontrasta za svijetlo zelenu ili pikrinsku kiselinu; prvi daje pozadinu zelenoj boji, a druga žutu boju.
Tehnika kinyoun posebna za Nocardias
Kako bi se poboljšalo bojenje bakterija Nocardia, koristi se modifikacija Kinyoun bojenja. Tehnika je sljedeća:
1 - pokriti razmaz s kinyoun fenicated fuchsin za 3 minute.
2 Isperite destiliranom vodom.
3 - Kratko izbjeljivanje s 3% pripravljenim kiselim alkoholom dok se više ne unese boja.
4. Oprati ponovno destiliranom vodom.
5. Prekrijte preparat metilenskim plavim i ostavite 30 sekundi.
6. Isperite destiliranom vodom i osušite.
Kombinirana tehnika fenolnog i trikromnog fuksina modificiranog po Didieru
Ova tehnika se preporučuje za analizu uzoraka stolice u potrazi za kokcidijama i sporama Microsporidium sp u isto vrijeme Postupak koji se treba slijediti je sljedeći:
1 - Pokrijte razmaz s Kinyoun fenolnim fuksinom 10 minuta.
2. Uklonite boju i isperite destiliranom vodom.
3- Izbjeljivanje 30 sekundi s alkoholnom klorovodičnom kiselinom.
4. Oprati ponovno destiliranom vodom.
5. Pokrijte razmaz s trikromnom otopinom 30 minuta na 37 ° C.
6. Isperite destiliranom vodom.
7. Dekolorizirajte 10 sekundi alkoholom octenom kiselinom.
8 - Isperite razmaz za 30 sekundi pomoću 95% etanola.
Kontrola kvalitete
Kao pozitivna kontrola pripremaju se razmazi sa sojevima Mycobacterium tuberculosis i obojene pripremljenim reagensima kako bi se potvrdilo da bakterije uzimaju pravu boju (crveno-fuksija).
Negativne kontrole mogu se također koristiti pripremanjem razmaza bilo kojim sojem koji nije alkohol otporan na kiselinu, čime se potvrđuje da cijeli uzorak uzima boju kontrasta.
Kinyoun tehnika u usporedbi sa Ziehl tehnikom -Neelsen
Kinyoun tehnika je jednostavnija jer eliminira stupanj grijanja, ali njegova glavna prednost je da sprječava emisiju para, vrlo toksična i dugoročno uzrokuje rak. Kinyoun bojenje je stoga sigurnije za bojenje osoblja.
Važno je uzeti u obzir da je potrebno voditi računa da reagensi ne dođu u izravan dodir s kožom, jer su korozivni i izbjeljivač je zapaljiv.
Što se tiče nedostataka, negativni razmaz ne znači nužno da mikroorganizam nije prisutan. Osim toga, prisutnost staničnog detritusa može uzrokovati lažne pozitivne rezultate, što stvara zabunu u dijagnozi.
upućivanje
- Primijenjena klinička kemija (2016). BK Kinyoun Kit Dostupno na: cromakit.es
- Orozco-Rico Miguel. Kinyoun mrlja i dvije Coccidia u HIV-u. Medicinski časopis MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Mikrobiološka dijagnoza Bailey & Scott. 12 ed. Argentina. Panamericana S.A Uvodnik.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiološka dijagnoza. (5. izd.). Argentina, Uredništvo Panamericana S.A..
- Doprinositelji Wikipedije. "Kinyoun mrlja." Wikipedija, slobodna enciklopedija. Wikipedija, Slobodna enciklopedija, 8. veljače 2018. Web. 5. siječnja 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Primjena tehnike bojanja za istovremenu dijagnozu Coccidia i Microsporidia. Institut za higijenu Sveučilišta u Republici. Montevideo. Urugvaj. Dostupno na: higiene.edu.uy


