Ziehl-Neelsen Stain Foundation, reagensi i tehnika
Ziehl-Neelsen mrlju u tehnici bojanja kako bi se identificirali mikroorganizmi otporni na alkohol i kiseline (AAR). Naziv ove mikrobiološke procedure odnosi se na autore: bakteriologa Franza Ziehla i patologa Friedricha Neelsena..
Ova tehnika je vrsta diferencijalne boje, koja podrazumijeva uporabu različitih boja kako bi se stvorio kontrast između struktura koje želite promatrati, razlikovati i kasnije identificirati. Ziehl-Neelsen mrlja se koristi za identifikaciju određenih vrsta mikroorganizama.
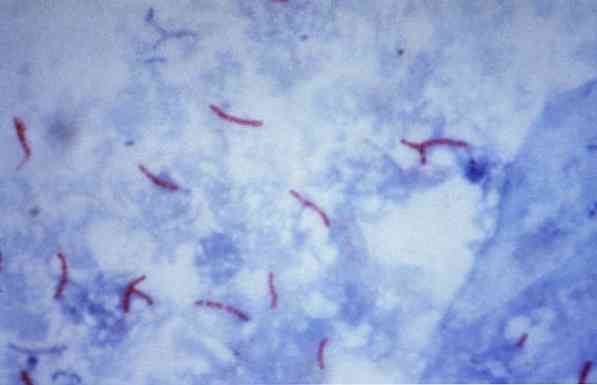
Neki od tih mikroorganizama su mikobakterije (na primjer, Mycobacterium tuberculosis), nokardije (na primjer, Nocardia sp.) i neki jednostanični paraziti (na primjer, Cryptosporidium parvum). Mnoge bakterije mogu se klasificirati kroz uobičajenu tehniku nazvanu Gram boja.
Međutim, neke bakterijske skupine zahtijevaju druge metode za njihovu identifikaciju. Tehnike kao što je Ziehl-Neelsen bojanje zahtijevaju kombinacije boja s toplinom da bi se prva fiksirala na staničnu stijenku.
Zatim dolazi do procesa diskoloracije koji omogućuje dva rezultata: otpornost ili osjetljivost na diskoloraciju kiselina i alkohola.
indeks
- 1 Temelj
- 1.1 Sekundarno bojanje
- 2 Reagensa
- 2.1 Primarno bojanje
- 2.2 Otopina za obezbojenje
- 2.3 Sekundarno bojanje (anti-kolorant)
- 3 Tehnika
- 3.1 Postupak bojenja brzim kiselinama
- 4 Reference
temelj
Osnova ove tehnike bojenja temelji se na svojstvima staničnih stijenki tih mikroorganizama. Zid oblikuje vrsta masnih kiselina koje se nazivaju mikoličke kiseline; Njih karakteriziraju vrlo dugi lanci.
Kada masne kiseline imaju vrlo dugu strukturu, lakše mogu zadržati boje. Neke rodove bakterija teško je obojiti bojom po Gramu, zbog visokog sadržaja mikolne kiseline u staničnoj stijenci.
U Ziehl-Neelsen boji koristi se fenolni spoj carbol fuchsin, osnovna boja. To ima sposobnost interakcije s masnim kiselinama stanične stijenke, što je voštana tekstura na sobnoj temperaturi.
Carbol fuchsin bojenje je poboljšano u prisutnosti topline, jer se vosak topi i molekule boje se brže kreću u staničnu stijenku.
Kiselina koja se kasnije koristi služi da obezboji stanice koje nisu bile obojene, jer njihov zid nije bio dovoljno povezan s bojom; prema tome, jačina dekolorizatora kiseline može ukloniti kiselinsku boju. Stanice koje se odupiru ovoj promjeni boje nazivaju se otporne na kiseline.
Sekundarno bojanje
Nakon promjene boje uzorka, to je u suprotnosti s drugom bojom zvanom sekundarna boja. Općenito se koristi metilensko plava ili malahitno zelena.
Sekundarna boja boji pozadinski materijal i, prema tome, stvara kontrast strukturama koje su obojene u prvom koraku. Samo obojene stanice apsorbiraju drugu boju (anti-mrlju) i uzimaju boju, dok stanice otporne na kiselinu zadržavaju crvenu boju.
Taj se postupak često koristi za identifikaciju Mycobacterium tuberculosis i Mycobacterium leprae, koje se nazivaju bacili brzo-kiselinski.
reagensi
Primarno bojanje
Koristi se karboksin 0,3% fuksin (filtriran). Ta se boja priprema iz smjese alkohola: fenola u etanolu (90%) ili metanola (95%), au toj se smjesi otopi 3 grama bazičnog fuksina..
Otopina za obezbojenje
U ovom koraku možete koristiti otopine 3% alkoholne kiseline ili 25% sumporne kiseline.
Sekundarno bojanje (protiv bojanja)
Boja koja se najčešće koristi za izvođenje kontrasta u uzorcima je obično 0,3% metilensko plavo. Međutim, mogu se koristiti i drugi, kao što je 0,5% -tna malahit zelena.
tehnika
Postupak bojenja s kiselom kiselinom
Pripremite bakterijski razmaz
Priprema se vrši na čistom i suhom klizaču, slijedeći mjere predostrožnosti.
Sušenje razmaza
Pustite da se razmaz isuši na sobnoj temperaturi.
Zagrijte uzorak
Uzorak se mora zagrijati primjenom požara na slajd ispod. Fiksacija s alkoholom može se učiniti kada se razmaz ne pripremi s ispljuvkom (tretira ga natrijevim hipokloritom kako bi ga izblijedio) i ako se neće odmah obojati..
M. tuberculosis Uklanja se izbjeljivačem i tijekom procesa bojenja. Termofiksiranje netretiranog sputuma neće ubiti M. tuberculosis, dok je fiksacija s alkoholom baktericidna.
Pokrijte mrlju
Mrlja je pokrivena otopinom karbol fuchsina (primarna osnovna mrlja).
Zagrijte mrlju
To je učinjeno 5 minuta. Trebate primijetiti otpuštanje pare (približno 60 ° C). Važno je ne pregrijavati se i izbjegavati paljenje uzorka.
Što se tiče zagrijavanja mrlje, pri grijanju fuksin karbola mora se paziti, osobito ako se bojenje provodi na pladnju ili drugom spremniku u kojem su iz prethodne mrlje prikupljene lako zapaljive kemikalije..
Samo mali plamen treba nanijeti ispod stakalca uz pomoć obrisanog brisa koji je prethodno navlažen s nekoliko kapi kiselog alkohola, metanola ili 70% etanola. Izbjegavajte uporabu velikog obriska namočenog u etanol jer je to opasnost od požara.
Operite mrlju
Ovo pranje treba obaviti čistom vodom. Ako voda iz slavine nije čista, operite razmaz filtriranom ili destiliranom vodom, po mogućnosti.
Pokrijte razmaz kiselim alkoholom
Taj kiselinski alkohol bi trebao biti 3%. Pokrivenost se provodi 5 minuta ili dok razmaz ne bude dovoljno izblijedio, tj. Blijedo ružičast.
Treba uzeti u obzir da je kiseli alkohol zapaljiv; stoga se mora koristiti vrlo pažljivo. Izbjegavajte blizinu izvora paljenja.
Operite mrlju
Pranje treba biti s čistom, destiliranom vodom.
Pokrijte mrlju bojom
Boja može biti zeleni malakit (0,5%) ili metilensko plavo (0,3%) tijekom 1 ili 2 minute, uz najduže vrijeme ako je razmaz tanak.
Operite mrlju
Čista voda se mora ponovno koristiti (destilirana).
odvod
Stražnji dio klizača treba očistiti i mrlju staviti na drenažnu policu, tako da se osuši na zraku (ne koristite upijajući papir za sušenje)..
Pregledajte razmaz u mikroskopu
Potrebno je koristiti objektiv 100X i ulje za uranjanje. Sustavno skenirajte razmaz i zapišite relevantna zapažanja.
Interpretirajte rezultate
Teoretski, mikroorganizmi koji su obojeni crvenkastom bojom smatraju se pozitivnim na kiselinu (AAR +).
Naprotiv, ako su mikroorganizmi obojeni plavom ili zelenom bojom, ovisno o boji koja se koristi kao protu-boja, smatraju se negativnom kiselinom otpornom na alkohol (AAR-).
reference
- Apurba, S. i Sandhya, B. (2016). Osnove praktične mikrobiologije (1. izd.). Jaypee Brothers Medicinski izdavači.
- Bauman, R. (2014). Mikrobiologija s bolestima tjelesnim sustavom (4. izd.). Pearson Education, Inc..
- Heritage, J., Evans, E. i Killington, A. (1996). Uvodna mikrobiologija (1. izd.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. i Morton, V. (2006). Priručnik za laboratorije i radna knjiga u mikrobiologiji: primjena na njegu bolesnika (11. izdanje). McGraw-Hill obrazovanje.
- Vasanthakumari, R. (2007). Udžbenik mikrobiologije (1. izd.). B.I. Publikacije PVT.


