Tipovi, svojstva, nomenklatura, upotreba i primjeri ketona
ketoni oni su organski spojevi koji posjeduju karbonilnu skupinu (-CO). Oni su jednostavni spojevi u kojima je ugljik karbonilne skupine vezan za dva ugljikova atoma (i njihove supstituentske lance). Ketoni su "jednostavni" jer nemaju reaktivne skupine poput -OH ili -Cl vezanih na ugljik.
Konačno, eliminacija ketona iz ljudskog tijela obično je povezana s niskom razinom šećera (u slučajevima dijabetesa i / ili ekstremnim postom), što može uzrokovati ozbiljne zdravstvene probleme za pacijenta..
indeks
- 1 Opća formula ketona
- 2 Vrste ketona
- 2.1 Prema strukturi vašeg lanca
- 2.2 Prema simetriji radikala
- 2.3 Prema zasićenju njegovih radikala
- 2.4 Diketoni
- 3 Fizikalna i kemijska svojstva ketona
- 3.1 Vrelište
- 3.2 Topljivost
- 3.3 Kiselost
- 3.4 Reaktivnost
- 4 Nomenklatura
- 5 Razlika između aldehida i ketona
- 6 Koristi u industrijskom i svakodnevnom životu
- Primjeri ketona
- 7.1 Butanon (C4H8O)
- 7.2 Cikloheksanon (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Reference
Opća formula ketona
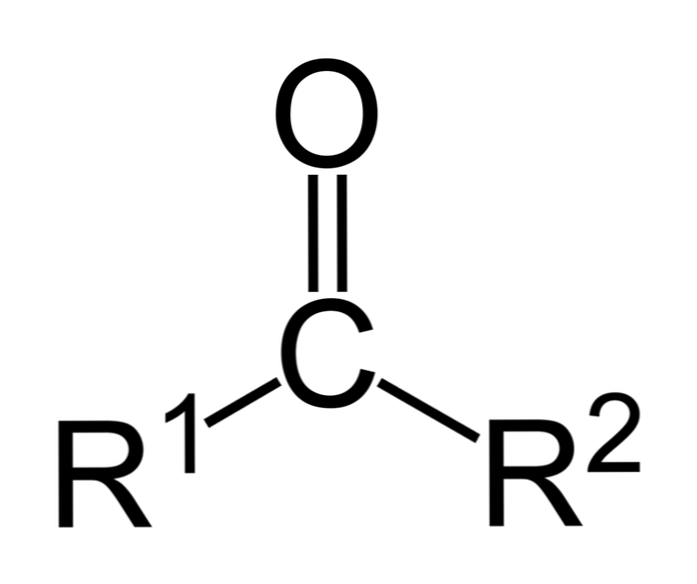
Ketoni su karbonilni spojevi u kojima je ova skupina vezana na dvije ugljikovodične skupine; to mogu biti alkilne skupine, skupine benzenskog prstena ili oboje.
Keton može jednostavno biti predstavljen kao R- (C = O) -R ', gdje R i R' su bilo koja dva ugljikovodična lanca (alkani, alkeni, alkini, cikloalkani, derivati benzena i drugi). Ne postoje ketoni s vodikom vezanim za karbonilnu skupinu.
Postoji širok izbor metoda za pripremu ketona u industrijskom i laboratorijskom okruženju; Osim toga, važno je napomenuti da ketoni mogu biti sintetizirani različitim organizmima, uključujući i ljude.
U industriji, najčešći način za sintezu ketona uključuje oksidaciju ugljikovodika, tipično uz upotrebu zraka. U maloj mjeri, ketoni se obično pripremaju oksidacijom sekundarnih alkohola, koji kao produkt daje keton i vodu.
Osim ovih najčešćih metoda, ketoni se mogu sintetizirati putem alkena, alkina, soli dušičnih spojeva, estera i mnogih drugih spojeva, što ih čini lakim za dobivanje.
Vrste ketona
Postoji nekoliko klasifikacija za ketone, ovisno uglavnom o supstituentima u njihovim lancima R. Sljedeće su najčešće klasifikacije za ove tvari:
Prema strukturi vašeg lanca
U ovom slučaju, keton je klasificiran prema načinu na koji je njegov lanac strukturiran: alifatski ketoni su oni koji imaju dva radikala R i R 'koji imaju oblik alkilnih radikala (alkani, alken, alkini i cikloalkani)..
Sa svoje strane, aromati su oni koji tvore derivate benzena, dok su još uvijek ketoni. Konačno, miješani ketoni su oni koji imaju R alkil radikal i R 'arilni radikal, ili obrnuto.
Prema simetriji njegovih radikala
U ovom slučaju proučavaju se radikali R i R 'supstituenti karbonilne skupine; kada su oni jednaki (identični), keton se naziva simetričan; ali kad su različiti (kao i većina ketona), to se naziva asimetričnim.
Prema zasićenju njegovih radikala
Ketoni se također mogu klasificirati prema zasićenju njihovih ugljikovih lanaca; Ako su u obliku alkana, keton se naziva zasićenim ketonom. Nasuprot tome, ako se lanci nalaze kao alkeni ili alkini, keton se naziva nezasićeni keton.
diketone
To je zasebna klasa ketona, budući da lanci ovog ketona u svojoj strukturi imaju dvije karbonilne skupine. Neki od ovih ketona imaju jedinstvene karakteristike, kao što je duža dužina veze između ugljika.
Na primjer, diketoni izvedeni iz cikloheksana poznati su kao kinoni, koji su samo dva: orto-benzokinon i para-benzokinon.
Fizikalna i kemijska svojstva ketona
Ketoni, kao i većina aldehida, su tekuće molekule i imaju niz fizičkih i kemijskih svojstava koja variraju ovisno o duljini njihovih lanaca. Njegova svojstva opisana su u nastavku:
Točka vrenja
Ketoni su visoko hlapljivi, visoko polarni i ne mogu darovati vodike za vodikove veze (ne posjeduju atome vodika koji su vezani za njihovu karbonilnu skupinu), tako da imaju više točke vrenja od alkena i etera, ali manje od onih alkohola iste molekularne težine.
Točka ključanja ketona raste s povećanjem veličine molekule. To je posljedica intervencije van der Waalsovih sila i dipol-dipolnih sila koje zahtijevaju veću količinu energije za razdvajanje atoma i elektrona privučenih molekulom..
topljivost
Topivost ketona ima snažan utjecaj djelomično na sposobnost tih molekula da prihvate vodike u svom kisikovom atomu i tako formiraju vodikovu vezu s vodom. Osim toga, između ketona i vode nastaju atraktivne, raspršene i dipol-dipolske sile koje povećavaju njihov topivi učinak.
Ketoni gube kapacitet topljivosti što je veća njihova molekula, budući da im je potrebno više energije za otapanje u vodi. Također su topljivi u organskim spojevima.
jetkost
Zahvaljujući svojoj karbonilnoj skupini, ketoni imaju kiselinsku prirodu; to se događa zbog sposobnosti rezonantne stabilizacije ove funkcionalne skupine, koja može prenijeti protone iz svoje dvostruke veze kako bi tvorila konjugiranu bazu zvanu enol.
reaktivnost
Ketoni su dio velikog broja organskih reakcija; to se događa zbog osjetljivosti karbonilnog ugljika na nukleofilnu adiciju, uz polaritet toga.
Kao što je gore navedeno, visoka reaktivnost ketona čini ih prepoznatim međuproizvodom koji služi kao osnova za sintezu drugih spojeva.
nomenklatura
Ketoni se nazivaju prema prioritetu ili važnosti karbonilne skupine u cijeloj molekuli, tako da kada imate molekulu kojom upravlja karbonilna skupina, keton se naziva dodavanjem sufiksa "-on" na ime ugljikovodika..
Najduži lanac s karbonilnom skupinom uzima se kao glavni lanac, a zatim se imenuje molekula. Ako karbonilna skupina nema prioritet u odnosu na druge funkcionalne skupine molekule, tada se identificira s "-oxo".
Za složenije ketone, položaj funkcionalne skupine može se identificirati s brojem, au slučaju diketona (ketoni s dva identična R i R 'supstituenta), naziva se molekula sa sufiksom "-dion"..
Konačno, riječ "keton" također se može upotrijebiti nakon identificiranja lanaca radikala vezanih na karbonilnu funkcionalnu skupinu.
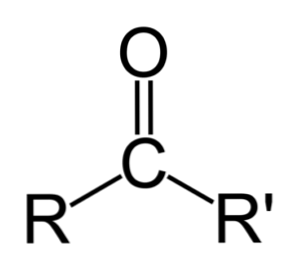
Razlika između aldehida i ketona
Najveća razlika između aldehida i ketona je prisutnost atoma vodika vezanog za karbonilnu skupinu u aldehidima.
Ovaj atom ima važan učinak kada je riječ o uključivanju molekule u oksidacijsku reakciju: aldehid će tvoriti karboksilnu kiselinu ili sol karboksilne kiseline, ovisno o tome da li se oksidacija odvija u kiselim ili bazičnim uvjetima.
Nasuprot tome, keton nema taj vodik, tako da se ne događaju minimalni koraci potrebni za oksidaciju.
Postoje metode za oksidaciju ketona (s mnogo jačim oksidacijskim sredstvima od onih koji se uobičajeno koriste), ali oni razbijaju ketonsku molekulu, odvajajući je najprije na dva ili više dijelova..
Industrijski i svakodnevni život koristi
U industriji se ketoni često promatraju u parfemima i bojama, uzimajući uloge stabilizatora i konzervansa koji sprječavaju razgradnju drugih komponenata smjese; oni također imaju širok spektar kao otapala u onim industrijama koje osim farmaceutskih proizvoda proizvode i eksploziv, boje i tekstil.
Aceton (najmanji i najjednostavniji keton) je otapalo priznato u cijelom svijetu, a koristi se kao odstranjivač boje i razrjeđivač.
U prirodi, ketoni se mogu pojaviti kao šećeri, koji se nazivaju ketoze. Ketoze su monosaharidi koji sadrže jedan keton po molekuli. Najpoznatija ketoza je fruktoza, šećer koji se nalazi u voću i medu.
Biosinteza masnih kiselina koja se javlja unutar citoplazme životinjskih stanica također se javlja djelovanjem ketona. Konačno, i kao što je gore spomenuto, može doći do povećanja ketona u krvi nakon posta ili u slučajevima dijabetesa.
Primjeri ketona
Butanon (C4H8O)
Također poznata kao MEK (ili MEC), ova se tekućina proizvodi u velikoj mjeri u industriji i koristi se kao otapalo.
Cikloheksanon (C6H10O)
Proizveden u masivnim količinama, ovaj keton se koristi kao prekursor sintetičkog materijala od najlona.
Testosteron (C19H22O2)
To je glavni hormon muškog spola i anabolički steroid koji se nalazi u većini kralježnjaka.
Progesteron (C21H30O2)
Endogeni steroid i spolni hormoni uključeni u menstrualni ciklus, trudnoća i embriogeneza kod ljudi i drugih vrsta.
reference
- Wikipedia. (N. D.). Ketona. Preuzeto s en.wikipedia.org
- Britannica, E. (s.f.). Ketona. Preuzeto s britannica.com
- Sveučilište, M.S. (s.f.). Aldehidi i ketoni. Preuzeto s kemije.msu.edu
- ChemGuide. (N. D.). Uvođenje aldehida i ketona. Preuzeto s chemguide.co.uk
- Calgary, U. O. (s.f.). Ketoni. Preuzeto s chem.ucalgary.ca


