Struktura, svojstva, sinteza i upotreba cikloheksena
cikloheksan R3 je alken ili ciklički olefin čija je molekulska formula C6H10. Sastoji se od bezbojne tekućine, netopiva u vodi i miješa se s mnogim organskim otapalima. Odlikuje se zapaljivošću, au prirodi se obično nalazi u ugljenom katranu..
Cikloheksen se sintetizira djelomičnom hidrogenacijom benzena i dehidracijom alkoholnog cikloheksanola; to jest, zarđali oblik. Kao i drugi cikloalkeni, on prolazi kroz reakcije elektrofilnog dodavanja i sa slobodnim radikalima; na primjer, reakcija halogeniranja.
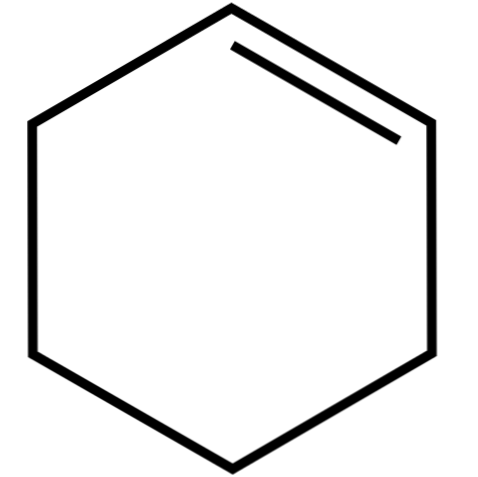
Ovaj ciklički alken (gornja slika) tvori azeotropne smjese (koje se ne mogu razdvojiti destilacijom), s nižim alkoholima i octenom kiselinom. Nije dugo stabilan u dugotrajnom skladištenju, jer se razgrađuje pod djelovanjem sunčeve svjetlosti i ultraljubičastog zračenja.
Cikloheksen se koristi kao otapalo i stoga ima brojne primjene, kao što su: stabilizator visokooktanskih benzina i ekstrakcija ulja.
Ali najvažnije je da cikloheksen služi kao intermedijer i sirovina za proizvodnju mnogih korisnih spojeva, među kojima su: cikloheksanon, adipinska kiselina, maleinska kiselina, cikloheksan, butadien, cikloheksilkarboksilna kiselina, itd..
indeks
- 1 Struktura cikloheksena
- 1.1 Međumolekularne interakcije
- 2 Svojstva
- 2.1 Kemijska imena
- 2.2 Molekularna težina
- 2.3 Fizički izgled
- 2.4 Miris
- 2.5 Vrelište
- 2.6 Točka taljenja
- 2.7 Plamište
- 2.8 Topljivost u vodi
- 2.9 Topljivost u organskim otapalima
- 2.10 Gustoća
- 2.11 Gustoća pare
- 2.12 Tlak pare
- 2.13 Automatsko paljenje
- 2.14 Raspadanje
- 2.15 Viskoznost
- 2.16 Toplina izgaranja
- 2.17 Toplina isparavanja
- 2.18 Površinska napetost
- 2.19 Polimerizacija
- 2.20 Prag praga mirisa
- 2.21 Indeks loma
- 2,22 pH
- 2.23 Stabilnost
- 2.24 Reakcije
- 3 Sažetak
- 4 Upotreba
- 5 Rizici
- 6 Reference
Struktura cikloheksena
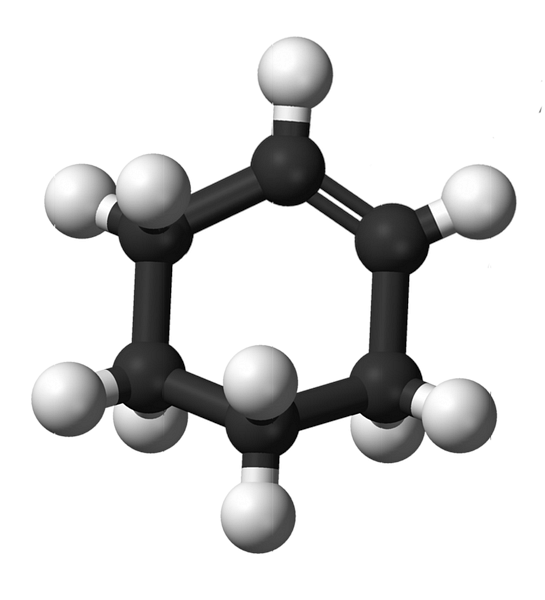
Struktura cikloheksena s modelom sfera i šipki prikazana je na slici iznad. Može se uočiti prsten od šest ugljika i dvostruka veza, obje nesaturacije spoja. Iz te perspektive, čini se da je prsten ravan; ali to uopće nije.
Za početak, ugljikovi dvostruke veze imaju sp hibridizaciju2, što im daje geometriju trigonalne ravnine. Stoga su ta dva ugljika, kao i oni koji se nalaze uz njih, u istoj ravnini; dok su dva ugljena na suprotnom kraju (na dvostruku vezu), iznad i ispod navedene ravnine.
Donja slika savršeno ilustrira ono što je upravo objašnjeno.

Zapamtite da se crni pojas sastoji od četiri ugljika: dva od dvostruke veze i drugih susjednih. Izložena perspektiva je ona koja bi se dobila kada bi gledatelj stavio svoje oko ispred dvostruke veze. Može se vidjeti da je ugljik iznad i ispod te ravnine.
Budući da molekula cikloheksena nije statična, dva ugljika će se izmijeniti: jedan će se smanjiti, a drugi će se uzdići iznad ravnine. Tako biste očekivali da se molekula ponaša.
Međumolekularne interakcije
Cikloheksen je ugljikovodik i stoga se njegove intermolekularne interakcije temelje na disperzijskim silama Londona..
To je zato što je molekula apolarna, bez stalnog dipolnog momenta, a njegova molekularna težina je čimbenik koji najviše pridonosi održavanju kohezivnosti u tekućini..
Također, dvostruka veza povećava stupanj interakcije, jer se ne može kretati s istom fleksibilnošću kao ona drugih ugljika, a to pogoduje interakciji između susjednih molekula. Iz tog razloga cikloheksen ima nešto višu točku vrenja (83 ° C) od cikloheksana (81 ° C)..
nekretnine
Kemijska imena
Cikloheksen, tetrahidrobenzen.
Molekularna težina
82,146 g / mol.
Fizički izgled
Bezbojna tekućina.
miris
Slatki miris.
Točka vrenja
83 ° C do 760 mmHg.
Točka taljenja
-103,5 ° C.
Točka paljenja
-7ºC (zatvorena šalica).
Topljivost u vodi
Gotovo netopljiv (213 mg / L).
Topljivost u organskim otapalima
Može se miješati s etanolom, benzenom, ugljikovim tetrakloridom, petrolej etrom i acetonom. Očekuje se da će moći rastopiti nepolarne spojeve, poput nekih alotropa ugljena.
gustoća
0.810 g / cm3 na 20 ° C.
Gustoća pare
2,8 (u odnosu na zrak koji se uzima kao jednak 1).
Tlak pare
89 mmHg na 25 ° C.
Samozapaljenja
244 ° C.
raspad
Raspada se u prisutnosti soli uranija pod djelovanjem sunčeve svjetlosti i ultraljubičastog zračenja.
viskoznost
0.625 mPascal na 25 ° C.
Toplina izgaranja
3,751.7 kJ / mol na 25 ° C.
Toplina isparavanja
30,46 kJ / mol na 25 ° C.
Površinska napetost
26,26 mN / m.
polimerizacija
Može se polimerizirati pod određenim uvjetima.
Prag mirisa
0,6 mg / m3.
Indeks loma
1.4465 na 20 ° C.
pH
7-8 na 20 ° C.
stabilnost
Cikloheksen nije jako stabilan tijekom dugotrajnog skladištenja. Izlaganje svjetlu i zraku može uzrokovati proizvodnju peroksida. Isto tako, nije kompatibilan s jakim oksidirajućim sredstvima.
reakcije
-Cikloalkeni uglavnom doživljavaju reakcije adicije, kako elektrofilne tako i slobodne radikale.
-Reakcija s bromom daje 1,2-dibromocikloheksan.
-Oksidira brzo u prisutnosti kalijevog permanganata (KMnO4).
-Sposoban je proizvesti epoksid (cikloheksen oksid) u prisutnosti peroksibenzojeve kiseline..
sinteza
Cikloheksen se proizvodi kiselom katalizom cikloheksanola:
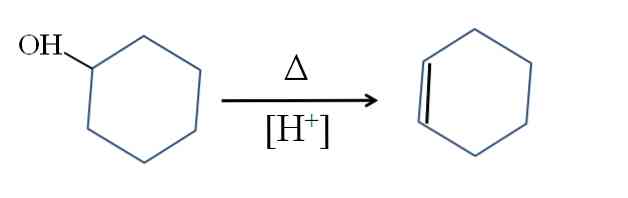
Simbol Δ predstavlja toplinu potrebnu za promicanje izlaza OH skupine kao molekule vode u kiselom mediju (-OH2+).
Cikloheksen se također proizvodi parcijalnom hidrogenacijom benzena; to jest, dvije njegove dvostruke veze dodaju molekulu vodika:
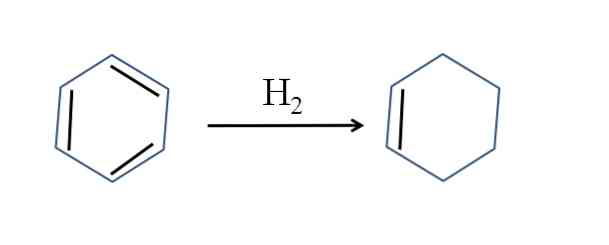
Iako je reakcija jednostavna, ona zahtijeva velike pritiske H2 i katalizatori.
aplikacije
-Koristi se kao organsko otapalo. Osim toga, on je sirovina za proizvodnju adipinske kiseline, adipinskog aldehida, maleinske kiseline, cikloheksana i cikloheksilkarboksilne kiseline..
-Koristi se u proizvodnji cikloheksan klorida, spoja koji se koristi kao posrednik u proizvodnji farmaceutskih proizvoda i aditiva u gumi..
-Cikloheksen se također koristi u sintezi cikloheksanona, sirovine za proizvodnju lijekova, pesticida, parfema i boja.
-Cikloheksen je uključen u sintezu aminocikloheksanola, spoja koji se koristi kao surfaktant i emulgator..
-Osim toga, cikloheksen se može koristiti za pripravu u laboratoriju butadiena. Potonji se spoj koristi u proizvodnji sintetičke gume, u proizvodnji guma za automobile, a koristi se iu proizvodnji akrilnih plastike.
-Cikloheksen je sirovina za sintezu lizina, fenola, policikloolefinske smole i aditiva gume.
-Koristi se kao stabilizator visokooktanskih benzina.
-Uključen je u sintezu vodootpornih premaza, filmova otpornih na pucanje i veznih veziva za premaze.
rizici
Cikloheksen nije vrlo toksičan spoj, ali može uzrokovati crvenilo kože i oči u kontaktu. Udisanje može izazvati kašalj i pospanost. Osim toga, njegovo gutanje može izazvati pospanost, otežano disanje i mučninu.
Cikloheksen se slabo apsorbira u gastrointestinalnom traktu, tako da se ne očekuju ozbiljni sustavni učinci zbog gutanja. Najveća komplikacija je njezina aspiracija dišnog sustava, koja može proizvesti kemijsku upalu pluća.
reference
- Joseph F. Chiang i Simon Harvey Bauer. (1968). Molekularna struktura cikloheksena. J. Am.Chem.Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cikloheksen: opasnosti, sinteza i struktura. Studija. Preuzeto s: study.com
- Morrison, R.T. i Boyd, R.N. (1987). Organska kemija (5tA Izdanje.). Uvodnik Addison-Wesley Iberoamericana.
- Pubchem. (2019). Cikloheksen. Preuzeto s: pubchem.ncbi.nlm.nih.gov
- Kemijska knjiga. (2019). Cikloheksen. Preuzeto s: chemicalbook.com
- Mreža toksikoloških podataka. (2017). Cikloheksen. Toxnet. Preuzeto s: toxnet.nlm.nih.gov
- Chemoxy. (N. D.). Strukturna formula za cikloheksen je. Preuzeto s: chemoxy.com


