Formula propanske kiseline, svojstva, rizici i uporaba
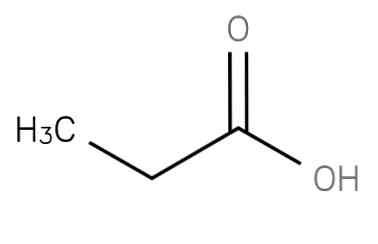
propansku kiselinu "Heteroaril" je zasićena masna kiselina kratkog lanca koja sadrži etan vezan na ugljik karboksi skupine. Njegova formula je CH3-CH2-COOH. Anion CH3CH2COO- kao i soli i esteri propaninske kiseline poznati su kao propionati (ili propanoati).
Može se dobiti iz otpadne drvne pulpe fermentacijom pomoću bakterija iz roda Propionibacterium. Također se dobiva iz etanola i ugljičnog monoksida upotrebom katalizatora od bor trifluorida (O'Neil, 2001).
Drugi način dobivanja propanske kiseline je oksidacijom propionaldehida u prisutnosti kobaltnih ili manganovih iona. Ova reakcija se brzo razvija na temperaturama od samo 40-50 ° C:
2CH3CH2CHO + O2 → 2CH3CH2COOH
Spoj je prirodno prisutan na niskim razinama u mliječnim proizvodima i proizvodi se u općem obliku, zajedno s drugim masnim kiselinama kratkog lanca, u gastrointestinalnom traktu ljudi i drugih sisavaca kao konačni proizvod mikrobne digestije ugljikohidrata..
Ima značajnu fiziološku aktivnost kod životinja (baza podataka o ljudskim metabolima, 2017.) \ T.
indeks
- 1 Fizikalna i kemijska svojstva
- 2 Reaktivnost i opasnosti
- 3 Biokemija
- 4 Upotreba
- 5 Reference
Fizikalna i kemijska svojstva
Propanična kiselina je bezbojna i uljna tekućina s oštrim, neugodnim i užeženim mirisom. Njezin izgled prikazan je na slici 2 (Nacionalni centar za biotehnološke informacije, 2017.) \ T.

Propaninska kiselina ima molekulsku masu od 74,08 g / mol i gustoću od 0,992 g / ml. Njegova točka smrzavanja i vrelište su -20,5 ° C odnosno 141,1 ° C. Propaninska kiselina je slaba kiselina čija je pKa 4,88.
Spoj je vrlo topljiv u vodi i može otopiti 34.97 grama spoja na 100 ml otapala. Također je topljiv u etanolu, eteru i kloroformu (Royal Society of Chemistry, 2015).
Propaninska kiselina ima srednja fizikalna svojstva između manjih karboksilnih kiselina, mravlje i octene kiseline i većih masnih kiselina.
Prikazuju se opća svojstva karboksilnih kiselina i mogu tvoriti amidne, esterske, anhidridne i kloridne derivate. Može se podvrgnuti alfa-halogenaciji s bromom u prisutnosti PBr3 kao katalizatora (reakcija HVZ) da se dobije CH3CHBrCOOH.
Reaktivnost i opasnosti
Propaninska kiselina je zapaljiv i zapaljiv materijal. Može se zapaliti toplinom, iskrama ili plamenom. Pare mogu stvoriti eksplozivne smjese s zrakom, koje mogu putovati do izvora paljenja i eksplodirati.
Većina pare je teža od zraka. Rasprostirat će se uz tlo i skupljat će se u niskim ili zatvorenim područjima (kanalizacija, podrumi, spremnici). Opasnost od eksplozije pare u zatvorenom prostoru, na otvorenom ili u kanalizaciji.
Tvari označene s (P) mogu polimerizirati eksplozivno kada se zagrijavaju ili pakuju u vatru. Kontejneri mogu eksplodirati pri zagrijavanju (PROPIONIC ACID, 2016).
Spoj treba držati podalje od topline ili izvora paljenja. Kod zagrijavanja do raspadanja ispušta se opor dim i nadražujuće pare.
Propanična kiselina iritira kožu, oči, nos i grlo, ali ne izaziva akutne sistemske učinke i nema vidljiv genotoksični potencijal. U slučaju kontakta treba oprati s mnogo vode (Sigurnosno-tehnički list Propionska kiselina, 2013).
biokemija
Konjugat baza propionske kiseline, propionat, oblikovan kao terminalnom fragmentu tri ugljika (aktiviran kao koenzim A propionil-CoA) u oksidaciju masnih kiselina neparnim brojem ugljika i oksidacijom u bočnom lancu holesterol.
Eksperimenti s radioaktivnim izotopima propionata koji su ubrizgani na štakorima natašte ukazuju na to da se mogu pojaviti u glikogenu, glukozi, intermedijerima ciklusa limunske kiseline, aminokiselinama i proteinima.
Put metabolizma propanske kiseline uključuje interakciju s koenzimom A, karboksilaciju da se formira metilmalonil-koenzim A, i konverzija u jantarnu kiselinu, koja ulazi u ciklus limunske kiseline.
Propaninska kiselina može se oksidirati bez stvaranja ketonskih tijela i, za razliku od octene kiseline, ugrađena je u ugljikohidrate kao i lipid (Bingham, Cohrssen, & Powell, 2001).
Propionska acidurija jedna je od najčešćih organskih acidurija, bolesti koja obuhvaća mnoge različite poremećaje.
Ishod bolesnika s propionske aciduria je rođen loše obrasce intelektualni razvoj, s 60% imaju nižu IQ od 75 i zahtijevaju posebnu edukaciju.
Uspješni transplantati jetre i / ili bubrega kod nekoliko pacijenata rezultirali su boljom kvalitetom života, ali nisu nužno spriječili neurološke i visceralne komplikacije.
Ovi rezultati naglašavaju potrebu za stalnim praćenjem metabolizma, neovisno o terapijskoj strategiji.
aplikacije
Propaninska kiselina inhibira rast bakterija i plijesni na razinama između 0,1 i 1 mas.%. Kao rezultat toga, većina proizvedene propaninske kiseline se konzumira kao konzervans i za hranu i za hranu za ljudsku potrošnju kao što su žitarice i žitarice..
Očuvanje hrane za životinje, žitarica i hrane, kao i proizvodnja kalcijevog i natrijevog propionata koja predstavlja gotovo 80% svjetske potrošnje propanske kiseline u 2016., u odnosu na 78,5% u 2012. godini.
Približno 51% svjetske potrošnje propionske kiseline je namijenjen za hranu i očuvanje zrna životinja, dok je gotovo 29% se koristi u proizvodnji propionata kalcija i natrij, koja se također koristi u prehrambenoj industriji i životinje.
Ostala važna tržišta za proizvodnju propionske kiseline su herbicidi i dietil ketona. Donji volumen aplikacije uključuju dobivanje propionat celuloza acetat, lijekovi, estere otapala okusa i mirisa, plastifikatori, bojila i tekstila, kože i pomoćne gume.
Potražnja za propanskom kiselinom u velikoj mjeri ovisi o proizvodnji hrane za životinje i žitarica, zatim pakiranih i pekarskih proizvoda.
Izgledi za globalni rast propaninske kiseline i njezinih soli u stočnoj hrani / zrnu i očuvanju hrane su značajni (IHS Markit, 2016).
Ostala brzo rastuća tržišta uključuju estere propionata za otapala, kao što su n-butil propionat i pentil; Ti se esteri sve više koriste kao zamjena za otapala navedena kao opasni zagađivači zraka.
reference
- Bingham, E., Cohrssen, B., & Powell, C. (2001). Patty's Toxicology Volumes 1-9 5. izd. New York: John Wiley & Sons.
- EMBL-EBI. (2016., 14. listopada). propionska kiselina. Oporavio se od ChEBI: ebi.ac.uk.
- Baza podataka o metabolima ljudi. (2017., 2. ožujka). Propionska kiselina. Dobavljeno iz hmdb.ca: hmdb.ca.
- IHS Markit. (2016., prosinac). Priručnik o kemijskoj ekonomiji propionska kiselina. Dobavljeno iz ihs: ihs.com.
- Sigurnosno-tehnički list Propionska kiselina. (2013., 21. svibnja). Dobavljeno iz sciencelab: sciencelab.com.
- Nacionalni centar za biotehnološke informacije ... (2017., 22. travnja). PubChem Compound Database; CID = 1032. Preuzeto s pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001), The Merck Index - Enciklopedija kemikalija, lijekova i bioloških tvari, 13. izdanje, New Jersey: Merck and Co., Inc..
- PROPIONIČKA KISELINA. (2016). Preuzeto iz cameochemicals: cameochemicals.noaa.gov.
- Kraljevsko kemijsko društvo. (2015). Propionska kiselina. Preuzeto iz chemspider: chemspider.com.


