Svojstva, struktura, uporaba i rizici kositrovog klorida (SnCl2)
kalijev klorid (II) ili kositar klorida, kemijske formule SnCl2, je bijela kristalna čvrsta tvar, produkt reakcije kositra i koncentrirana otopina klorovodične kiseline: Sn (s) + 2HCl (konc) => SnCl2(aq) + H2(G). Proces njegove sinteze (pripreme) sastoji se od dodavanja komada kositrnih strugotina u reakciju s kiselinom.
Nakon dodavanja komada kositra, nastavlja se dehidracija i kristalizacija dok se ne dobije anorganska sol. U ovom spoju, kositar je izgubio dva elektrona iz svoje valentne ljuske da formira veze s atomima klora.
To se može bolje razumjeti ako se uzme u obzir valentna konfiguracija kositra (5s25px2pi0pz0), od kojih par elektrona zauzima orbitalu px je dana protonima H+, kako bi se formirala dijatomejska molekula vodika. To jest, ovo je reakcija redoks tipa.
indeks
- 1 Fizikalna i kemijska svojstva
- 1.1 Konfiguracija u Valenciji
- 1.2 Reaktivnost
- 1.3 Reduktivna aktivnost
- 2 Kemijska struktura
- 3 Upotreba
- 4 Rizici
- 5 Reference
Fizikalna i kemijska svojstva
SnCl veze2 Jesu li ionski ili kovalentni? Fizička svojstva kositar (II) klorida isključuju prvu opciju. Tališta i vrelišta za ovaj spoj su 247 ° C i 623 ° C, što ukazuje na slabe intermolekularne interakcije, česta činjenica za kovalentne spojeve.
Njezini kristali su bijeli, što se pretvara u apsorpciju nule u vidljivom spektru.
Valencia konfiguracija
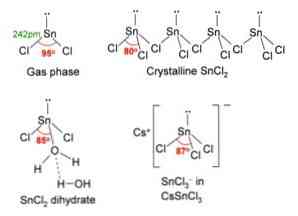
Na slici iznad, u gornjem lijevom kutu, prikazana je izolirana molekula SnCl2.
Molekularna geometrija treba biti ravna jer je hibridizacija središnjeg atoma sp2 (3 orbitalne sp2 i čista p orbitalna tvore kovalentne veze), ali slobodni par elektrona zauzima volumen i gura atome klora prema dolje, dajući molekuli kutnu geometriju.
U plinskoj fazi taj je spoj izoliran, tako da ne utječe na druge molekule.
Kao gubitak para elektrona u orbiti px, kositar se transformira u ion Sn2+ i rezultirajuća elektronička konfiguracija je 5s25px0pi0pz0, sa svim svojim p orbitale na raspolaganju za prihvaćanje linkova od drugih vrsta.
Ioni Cl- koordinirati s Sn ionom2+ da se dobije tin klorid. Elektronska konfiguracija kositra u ovoj soli je 5s25px2pi2pz0, biti u stanju prihvatiti još jedan par elektrona u slobodnoj orbitali pz.
Na primjer, možete prihvatiti drugi Cl ion-, formiranje kompleksa trigonalne geometrije (piramida s trokutnom bazom) i negativno nabijene [SnCl3]-.
reaktivnost
SnCl2 ima visoku reaktivnost i tendenciju da se ponaša kao Lewisova kiselina (elektronski receptor) da dovrši svoj valentni oktet.
Baš kao što prihvaća Cl ion-, isto se događa s vodom, koja "hidrira" atom kositra povezivanjem molekule vode izravno s kositrom, a druga molekula vode stvara interakcije vodikovih veza s prvim.
Rezultat toga je da je SnCl2 nije čista, već je koordinirana s vodom u svojoj dihidratnoj soli: SnCl2· 2H2O.
SnCl2 Vrlo je topljiv u vodi i polarnim otapalima, jer je polarni spoj. Međutim, njegova topljivost u vodi, manja od njezine mase, aktivira reakciju hidrolize (pucanje molekule vode) kako bi se dobila bazična i netopljiva sol:
SnC2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Dvostruka strelica pokazuje da je uspostavljena ravnoteža, preferirana lijevo (prema reaktantima) ako se koncentracije HCl povećaju. Za to, otopine SnCl2 Upotrijebljeni pH ima kiselinski pH, kako bi se izbjeglo taloženje neželjenog proizvoda hidrolize soli.
Reduktivna aktivnost
Reagira s kisikom u zraku u obliku kositrovog (IV) klorida ili klorida:
6 SnCl2(aq) + 02(g) + 2H2O (l) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
U ovoj reakciji kositar oksidira formirajući vezu s elektronegativnim atomom kisika i povećava broj veza s atomima klora.
Općenito, elektronegativni atomi halogena (F, Cl, Br i I) stabiliziraju veze spojeva Sn (IV) i ta činjenica objašnjava zašto je SnCl2 on je redukcijski agens.
Kada oksidira i izgubi sve svoje valentne elektrone, Sn ion4+ ostaje s konfiguracijom od 5s05px0pi0pz0, biti par elektrona u orbitalnim 5-ima najteže se "zgrabiti".
Kemijska struktura
SnCl2 predstavlja kristalnu strukturu ortoromskog tipa, sličnu redovima pila, u kojima su vrhovi zuba kloridi.
Svaki red je SnCl lanac3 formiranje Cl mosta s drugim Sn atomom (Cl-Sn (Cl)2-Cl- ···), kao što se može vidjeti na slici iznad. Dva lanca, povezana slabim interakcijama Sn-Cl tipa, tvore jedan sloj rasporeda, koji se nalazi na drugom sloju, i tako dalje dok se ne definira kristalna krutina.
Par slobodnih elektrona 5s2 uzrokuje izobličenja u strukturi jer zauzima volumen (volumen elektroničkog oblaka).
Sn može imati koordinacijski broj jednak devet, koji je isti kao da ima devet susjeda, crtajući trigonalnu prizmu koja se nalazi u središtu geometrijske figure i Cl u vrhovima, uz ostale Cl koje se nalaze u svakom kvadratnih lica prizme.
To je lakše promatrati ako se uzme u obzir lanac gdje Sn (tamno siva sfera) pokazuje prema gore, a tri Cl povezane na njega tvore trokutasti pod, dok tri gornja Cls tvore trokutasti krov..
aplikacije
U organskoj sintezi koristi se kao redukcijsko sredstvo za aromatske nitro spojeve (Ar-NO2 à Ar-NH2). Budući da je njegova kemijska struktura laminarna, ona se koristi u svijetu katalize organskih reakcija, osim što je potencijalni kandidat za katalitičku podršku..
Njegovo reducirajuće svojstvo koristi se za određivanje prisutnosti spojeva zlata, premazivanje naočala sa srebrnim ogledalima i djelovanje kao antioksidansa.
Također, u svojoj molekularnoj geometriji trigonalna piramida (: SnX3- M+) koristi se kao Lewisova baza za sintezu velikog broja spojeva (kao što je kompleks Pt klastera)3Sn8cl20, gdje je par bez elektrona koordiniran s Lewis-ovom kiselinom).
rizici
SnCl2 Može oštetiti bijele krvne stanice. To je korozivno, nadražujuće, kancerogeno i ima visoke negativne učinke na vrste koje obitavaju morski ekosustavi.
Može se raspasti pri visokim temperaturama, oslobađajući štetni plin klora. U kontaktu s visoko oksidirajućim agensima aktivira eksplozivne reakcije.
reference
- Shiver & Atkins. (2008). Anorganska kemija u Elementi skupine 14 (četvrto izdanje, str. 329). Mc Graw Hill.
- ChemicalBook. (2017). Preuzeto 21. ožujka 2018. godine iz tvrtke ChemicalBook: chemicalbook.com
- Pubchem. (2018.). Tin klorid. Preuzeto 21. ožujka 2018. godine iz PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Tin (II) klorid. Preuzeto 21. ožujka 2018. s Wikipedije: en.wikipedia.org
- E. G. Rochow, E.W. (1975). Kemija germanija: kositar i olovo (prvi ed.). p-82,83. Pergamom Press.
- F. Hulliger. (1976). Strukturna kemija faznih slojeva. P-120.121. D. Reidel Publishing Company.



