Raoultov zakon u kojem se sastoji, pozitivna i negativna odstupanja
Raoultov zakon predložio je francuski kemičar François-Marie Raoult 1887. godine i služi za objašnjenje ponašanja tlaka pare otopine dvije tvari koje se miješaju (tipično idealne) ovisno o parcijalnom tlaku pare svake komponente prisutne u ovoj.
Postoje zakoni kemije koji se koriste za opisivanje ponašanja tvari u različitim uvjetima i objašnjavaju pojave u kojima su uključeni, koristeći znanstveno dokazane matematičke modele. Raoultov zakon je jedan od tih.

Koristeći objašnjenje temeljeno na interakcijama između molekula plinova (ili tekućina) za predviđanje ponašanja tlakova pare, ovaj se zakon koristi za proučavanje neidealnih ili stvarnih rješenja, pod uvjetom da se uzmu u obzir potrebni koeficijenti za ispravljanje modela matematički i prilagoditi ga neidealnim uvjetima.
indeks
- 1 Od čega se sastoji??
- 2 Pozitivna i negativna odstupanja
- 2.1 Pozitivna odstupanja
- 2.2 Negativna odstupanja
- 3 Primjeri
- 3.1 Osnovna smjesa
- 3.2. Binarna smjesa s nehlapljivom otopljenom tvari
- 4 Reference
Od čega se sastoji??
Raoultov zakon temelji se na pretpostavci da se uključena rješenja ponašaju na idealan način: to se događa zato što se ovaj zakon temelji na ideji da su intermolekularne sile između različitih molekula iste kao one između sličnih molekula (koje u stvarnosti nije tako uspješna).
Zapravo, što je rješenje idealnije, to će više biti mogućnosti za ispunjavanje karakteristika koje predlaže ovaj zakon..
Ovaj zakon povezuje tlak pare otopine s nehlapljivom otopljenom tvari, navodeći da će biti jednak tlaku pare te čiste otopljene tvari pri toj temperaturi, pomnoženoj s njegovim molarnim frakcijama. To se izražava matematičkim izrazima za jednu komponentu na sljedeći način:
Pja = Pºja . Xja
U ovom izrazu Pja jednak je parcijalnom tlaku pare komponente i u mješavini plina, P °ja je tlak pare čiste komponente i i Xja je molarni udio komponente i u smjesi.
Na isti način, kada imate nekoliko komponenti u otopini i koje su dostigle stanje ravnoteže, možete izračunati ukupni tlak pare otopine kombinirajući Raoultov zakon s Daltonovim:
P = P °X + PºBXB + PºCXc...
Također, u onim otopinama gdje su prisutna samo jedna otopljena tvar i otapalo, zakon se može formulirati kao što je prikazano ispod:
P = (1-XB) x Pº
Pozitivna i negativna odstupanja
Rješenja koja se mogu proučavati ovim zakonom normalno bi se trebala ponašati idealno, budući da su interakcije između njihovih molekula male i dopuštaju da se ista svojstva pretpostavljaju kroz rješenje bez iznimke..
Međutim, idealna rješenja praktički ne postoje, tako da se u izračune koji predstavljaju intermolekularne interakcije moraju ugraditi dva koeficijenta. To su koeficijent fugantnosti i koeficijent aktivnosti.
U tom smislu, odstupanja u odnosu na Raoultov zakon definirana su kao pozitivna ili negativna, ovisno o rezultatima dobivenim u to vrijeme.
Pozitivna odstupanja
Pozitivna odstupanja u odnosu na Raoultov zakon javljaju se kada je tlak pare otopine veći od onoga što je izračunato Raoultovim zakonom.
To se događa kada su kohezijske sile između sličnih molekula veće od istih sila između različitih molekula. U ovom slučaju, obje se komponente lakše isparavaju.
Ovo odstupanje se vidi u krivulji tlaka pare kao maksimalna točka u određenom sastavu, tvoreći pozitivan azeotrop.
Azeotrop je tekuća smjesa dvaju ili više kemijskih spojeva koji se ponašaju kao da su formirani od jedne komponente i koja isparava bez mijenjanja sastava.
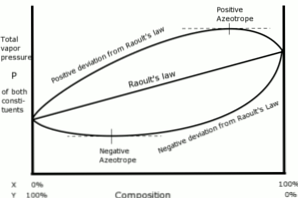
Negativna odstupanja
Negativna odstupanja od Raoultovog zakona javljaju se kada je tlak pare smjese niži od očekivanog nakon računanja sa zakonom.
Ta se odstupanja pojavljuju kada su kohezijske sile između molekula mješavine veće od prosjeka sila između čestica tekućine u njihovom čistom stanju..
Ova vrsta odstupanja generira zadržavanje svake komponente u svom tekućem stanju privlačnim silama većim od onih u tvari u čistom stanju, tako da je parcijalni tlak pare sustava smanjen.
Negativne azeotropne krivulje tlaka pare predstavljaju minimalnu točku i pokazuju afinitet između dvije ili više komponenti uključenih u smjesu.
Primjeri
Raoultov zakon se uobičajeno koristi za izračunavanje tlaka otopine na temelju njegovih intermolekularnih sila, uspoređujući izračunate vrijednosti s realnim vrijednostima kako bismo zaključili postoji li odstupanje i treba li to biti pozitivno ili negativno. U nastavku su dva primjera uporabe Raoultovog zakona:
Osnovna smjesa
Sljedeća smjesa, koja se sastoji od propana i butana, predstavlja aproksimaciju tlaka pare i možemo pretpostaviti da su obje komponente u jednakim omjerima unutar nje (50-50), na temperaturi od 40 ° C:
Xpropan = 0.5
Pºpropan = 1352,1 kPa
Xbutan = 0.5
Pºbutan = 377,6 kPa
Izračunava se prema Raoultovom zakonu:
Psmjesa = (0.5 x 377.6 kPa) + (0.5 x 1352.1 kPa)
Dakle:
Psmjesa = 864,8 kPa
Binarna smjesa s nehlapljivom otopljenom tvari
Ponekad se dogodi da je otopljena smjesa nehlapljiva, tako da se zakon koristi za razumijevanje ponašanja tlaka pare.
Dobivena je mješavina vode i šećera u omjeru 95% odnosno 5% i pod normalnim temperaturnim uvjetima:
Xvoda = 0.95
Pºvoda = 2.34 kPa
Xšećer = 0.05
Pºšećer = 0 kPa
Izračunava se prema Raoultovom zakonu:
Psmjesa = (0.95 x 2.34 kPa) + (0.05 x 0 kPa)
Dakle:
Psmjesa = 2.22 kPa
Očito je došlo do smanjenja tlaka vodene pare zbog djelovanja intermolekularnih sila.
reference
- Anne Marie Helmenstine, P. (s.f.). Raoultova definicija zakona. Preuzeto s thoughtco.com
- ChemGuide. (N. D.). Raoultov zakon i nestalne otopine. Preuzeto s chemguide.co.uk
- LibreTexts. (N. D.). Raoultov zakon i idealne smjese tekućina. Preuzeto s chem.libretexts.org
- Neutrium. (N. D.). Raoultov zakon. Preuzeto s neutrium.net
- Wikipedia. (N. D.). Raoultov zakon. Preuzeto s en.wikipedia.org


