Kemijska struktura, svojstva i upotreba manganovog oksida (MnO2)
manganov oksid (MnO2) je anorganski kemijski spoj koji tvori element mangan s oksidacijskim brojem +4 i kisikom, koji pri stvaranju oksida ima oksidacijski broj -2. Također je poznat po imenima manganov (IV) oksid i manganov anhidrid.
Čvrsta je od tamne do crne kave. Ona je u prirodi kao mineralni pirolusit, crni i kristalizirani formirajući dendriti (razgranati izduženja). Može se dobiti kao crni ostatak u reakciji između etilena i kalijevog permanganata nakon stvaranja glikola oksidirajućim djelovanjem kalijevog permanganata..

To je vrlo važno u industriji stakla zbog svog karaktera oksidirajućeg agensa, jer uklanja zelenu boju koja dolazi od spojeva željeza i pretvara ih u željezne.
indeks
- 1 Kemijska struktura
- 2 Svojstva
- 3 Upotreba
- 3.1 Kao katalizator
- 4 Učinci na zdravlje
- 5 Reference
Kemijska struktura
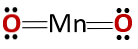
Kemijska struktura spoja odgovara onoj anhidrida, a ne strukturi bazičnog oksida, kao što bi se očekivalo jer se sastoji od metala i nemetala.
Ovaj poseban slučaj je posljedica ponašanja koje mangan ima u različitim oksidacijskim stanjima. Tako za oksidacijska stanja +2 i +3 formiraju se oksidi MnO i Mn2O3 odnosno, da pri reakciji s vodom tvore manganov hidroksid, odnosno manganov hidroksid.
Međutim, Mn2O3 u blago kiselom mediju ponaša se kao anhidrid. Kod oksidacijskih stanja +4, +6 i +7, MnO2, MnO3 i MnO4 oni stvaraju kiseline kada reagiraju s vodom.
U blago kiselom mediju MnO2 ponaša se kao osnovni oksid, tako da može tvoriti odgovarajući hidroksid.

Treba imati na umu da se u ovom slučaju ne spominju amfoterna svojstva, prema kojima se spoj može ponašati kao kiselina ili kao baza. Ovo je poseban slučaj ponašanja Mn.
nekretnine
aplikacije
- Koristi se kao izvor mangana
- Kao oksidant u alkalnim baterijama
- Boje za staklo, keramiku i porculan.
- U dobivanju klora i joda.
- U razgradnji vodikovog peroksida za stvaranje plinovitog kisika i vode.
- U reakciji razgradnje kalijevog klorata za proizvodnju plinovitog kisika i kalijevog klorida.
- Otopljen u acetonu ili diklorometanu, oksidira primarne alkohole u aldehide i sekundarne u ketone.
- Proizvodnja alkalnih baterija.
Kao katalizator
To se odnosi na reakcije redukcije oksida, za uklanjanje sulfida kao što je H2S i kationi poput Fe+2 i Mn+2 , arsen i radio u podzemnim vodama koje su onečišćene ovom vrstom spojeva.
Ovo onečišćenje može nastati ili nekontroliranim odlaganjem otrovnih materijala, pranjem kontaminiranog tla ili prisutnošću kemijskih elemenata u vrijeme dobivanja vode..
MnO2 Visoka čistoća dobivena iz piroluzita korištenog kao filtar (Filox) je najučinkovitije sredstvo za uklanjanje ove klase nečistoća iz podzemnih voda.
Učinci na zdravlje
- Izbjegavajte kontakt s kožom.
- U slučaju kontakta, oprati odgovarajuće područje.
- Ne udišite prah.
- Iritacija i crvenilo se mogu vidjeti u kontaktu s očima. Isperite s mnogo vode, pustite da voda teče kroz oči i zatražite liječničku pomoć u slučaju ozbiljnih smetnji.
- U dodiru s kožom uočena je iritacija i crvenilo. Operite zahvaćeno područje s mnogo vode i sapuna.
- Dugotrajni kontakt s kožom uklanja vašu prirodnu mast, izazivajući dermatitis.
- Udisanje može prouzročiti stanje slično gripu (metalne pare). Stanje karakterizira visoka temperatura, zimica, suha usta i grlo, bolovi u mišićima i glavobolja.
- Može nadražiti dišne putove i povećati učestalost respiratornih infekcija (pneumonija). Intoksikacija apsorpcijom anorganskih soli mangana kroz pluća je malo vjerojatna, ali može doći do kroničnog trovanja.
- Kronična izloženost prašini ili dimu manganovog dioksida tijekom dugog razdoblja može utjecati na središnji živčani sustav i dovesti do razvoja Parkinsonove bolesti, poteškoća s hodanjem, grčeva mišića i promjena u ponašanju..
- Gutanje može uzrokovati bol u trbuhu i mučninu.
- Nije zapaljiv, ali pomaže u širenju vatre u užarenim materijalima. Ako se zagrije na temperaturu iznad 535 ° C, tvar se raspada na manganov oksid (III) Mn2O3 i kisik, koji je zapaljiv i povećava opasnost od požara. U tom slučaju požar treba ugasiti pjenom ili ugljičnim dioksidom.
- U slučaju izlijevanja, nemojte rukovati spojem bez odgovarajuće osobne zaštite.
- Skladištite u dobro zatvorenim spremnicima, na hladnom i suhom mjestu i dalje od nekompatibilnih tvari kao što su organski materijali i zapaljivi materijali.
- Skladište mora biti suho i mora imati podove otporne na kiselinsku koroziju i dobru drenažu..
- Treba koristiti osobnu zaštitnu opremu, kao što su rukavice, zaštitne naočale, maske protiv pare, prašina i dim.
reference
- B, (2015), Manganov dioksid, Kraljevsko kemijsko društvo - svijet kemije, preuzeto iz chemistryworld.com
- Karal, (2014), Mangneso dioksid, sigurnosno-tehnički list, izvučen iz, karal.com.mx
- Vaš virtualni učitelj (2015/2/25). Manganski anorganski spojevi (poseban slučaj 1) - Teorijska lekcija, preuzeto iz, youtube.com
- Ecured, (s.f), manganov dioksid, dobiven iz ecured.cu
- Angarita G, Johnny., (2017.), manganov dioksid: iznimna tehnologija. Hidroteco, oporavljena od hydrotecocr.com
- Fernández, G., (2015), MnO manganov dioksid2/ aceton, Organska kemija, Oporavio se od quimicaorganica.net
- Tronox, (2011), manganov dioksid, sigurnosno-tehnički list, izvučen iz, tronox.com


