Struktura, svojstva, nomenklatura i upotreba zlatnog oksida (III) (Au2O3)
zlatni oksid (III) je anorganski spoj čija je kemijska formula Au2O3. Teoretski se može očekivati da je njegova priroda kovalentnog tipa. Međutim, prisutnost određenog ionskog karaktera u njegovoj krutini ne može se potpuno odbaciti; ili što je isto, pretpostaviti odsutnost licence3+ pored aniona O2-.
Može se činiti proturječno da zlato, kao plemeniti metal, može hrđati. U normalnim uvjetima, komadi zlata (poput zvijezda na slici ispod) ne mogu se oksidirati kontaktom s kisikom u atmosferi; međutim, kada je ozračena ultraljubičastim zračenjem u prisutnosti ozona, OR3, slika je drugačija.

Da su zlatne zvijezde bile podvrgnute tim uvjetima, pretvorile bi se u crvenkasto smeđu, karakterističnu za Au2O3.
Druge metode za dobivanje tog oksida uključuju kemijsku obradu navedenih zvijezda; na primjer, pretvaranje zlatne mase u odgovarajući klorid, AuCl3.
Nakon toga, na AuCl3, i ostatak od mogućih nastalih soli zlata, dodan je jak bazični medij; s tim dobivate hidrirani oksid ili hidroksid, Au (OH)3. Konačno, ovaj posljednji spoj se termički dehidrira da se dobije Au2O3.
indeks
- 1 Struktura zlatnog oksida (III)
- 1.1 Elektronski aspekti
- 1.2 Hidrati
- 2 Svojstva
- 2.1 Fizički izgled
- 2.2 Molekulska masa
- 2.3 Gustoća
- 2.4 Točka taljenja
- 2.5 Stabilnost
- 2.6 Topljivost
- 3 Nomenklatura
- 4 Upotreba
- 4.1 Bojenje naočala
- 4.2 Sinteza aurata i fulminirajućeg zlata
- 4.3 Rukovanje samostalnim slojevima
- 5 Reference
Struktura zlatnog oksida (III)
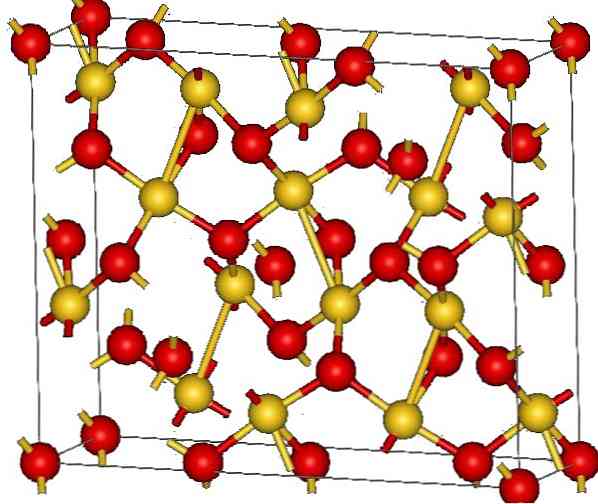
Kristalna struktura zlata (III) oksida prikazana je na gornjoj slici. Prikazan je raspored atoma zlata i kisika u krutini, bilo kao neutralni atomi (kovalentna kruta tvar), ili kao ioni (ionska krutina). Nejasno je dovoljno ukloniti ili postaviti Au-O veze u svakom slučaju.
Prema slici, pretpostavlja se da prevladava kovalentni karakter (što bi bilo logično). Iz tog razloga, predstavljeni atomi i veze prikazani su sferama i stupcima. Zlatne kugle odgovaraju atomima zlata (AuIII-O), i crvenkaste do atoma kisika.
Ako pažljivo pogledate, vidjet ćete da postoje AuO jedinice4, koji su spojeni atomima kisika. Drugi način da se vizualizira bilo bi uzeti u obzir da je svaka Au3+ je okružen s četiri O2-; Naravno, iz ionske perspektive.
Ova struktura je kristalna jer su atomi uređeni u skladu s istim dugim rasponom. Dakle, njegova jedinstvena stanica odgovara romboedarnom kristalnom sustavu (isto kao i na gornjoj slici). Dakle, sve Au2O3 može se izgraditi ako su sve te sfere jedinične ćelije raspodijeljene u prostoru.
Elektronski aspekti
Zlato je prijelazni metal, te se može očekivati da njegove 5d orbitale izravno djeluju s 2p orbitalima atoma kisika. Ovo preklapanje njihovih orbitala teoretski bi trebalo generirati provodne trake, koje bi pretvorile Au2O3 u čvrstom poluvodiču.
Stoga, istinska struktura Au2O3 s tim je još složenija.
hidratima
Zlatni oksid može zadržati molekule vode unutar svojih romboedričnih kristala, što dovodi do hidrata. Kada se takvi hidrati formiraju, struktura postaje amorfna, tj. Neuređena.
Kemijska formula za takve hidrate može biti bilo koje od sljedećeg, što zapravo nije duboko razjašnjeno: Au2O3ZH2O (z = 1, 2, 3, itd.), Au (OH)3, ili AuxOi(OH)z.
Formula Au (OH)3 predstavlja pretjerano pojednostavljenje pravog sastava navedenih hidrata. To je zbog toga što su unutar zlatnog hidroksida (III) istraživači također pronašli prisutnost Au2O3; i stoga, ima smisla tretirati ga izolirano kao "jednostavni" hidroksid prijelaznog metala.
S druge strane, krutina s formulom AuxOi(OH)z može se očekivati amorfna struktura; budući da to ovisi o koeficijentima x, i i z, čije bi varijacije dovele do svih vrsta struktura koje jedva mogu pokazati kristalni uzorak.
nekretnine
Fizički izgled
To je crvenkasto smeđa krutina.
Molekulska masa
441,93 g / mol.
gustoća
11,34 g / ml.
Točka taljenja
Topi se i razgrađuje na 160ºC. Zbog toga nedostaje točka vrenja, tako da ovaj oksid nikada ne dosegne točku vrenja.
stabilnost
Au2O3 ona je termodinamički nestabilna jer, kao što je spomenuto na početku, zlato ne nastoji oksidirati u normalnim temperaturnim uvjetima. Tako se lako reducira da postane ponovno plemenito zlato.
Što je temperatura viša, to je brža reakcija, poznata kao termička razgradnja. Dakle, Au2O3 na 160 ° C razgrađuje se kako bi proizveo metalno zlato i oslobodio molekularni kisik:
2 Au2O3 => 4 Au + 3 O2
Vrlo slična reakcija može se pojaviti s drugim spojevima koji favoriziraju spomenuto smanjenje. Zašto smanjenje? Zato što se zlato vraća kako bi zadobilo elektrone koje mu je kisik oduzeo; što je isto kao da kaže da gubi vezu s kisikom.
topljivost
To je krutina netopljiva u vodi. Međutim, topiv je u klorovodičnoj kiselini i dušičnoj kiselini, zbog stvaranja klorida i nitrata zlata.
nomenklatura
Zlatni oksid (III) naziv je nomenklature zaliha. Drugi načini za spomenuti su:
-Tradicionalna nomenklatura: aurerični oksid, jer je valencija 3+ najviša za zlato.
-Sustavna nomenklatura: dioro trioksid.
aplikacije
Bojanje naočala
Jedna od njegovih najistaknutijih primjena je pružanje crvenkastih boja određenim materijalima, kao što su naočale, uz dodavanje određenih svojstava svojstvenih atomima zlata..
Sinteza aurata i punog zlata
Ako se doda Au2O3 na medij u kojem je topljiv, a u prisutnosti metala, aurati se mogu taložiti nakon dodavanja jake baze; koji su formirani od AuO aniona4- u društvu metalnih kationa.
Također, Au2O3 reagira s amonijakom kako bi se dobilo zlatno punjenje, Au2O3(NH3)4. Njegovo ime proizlazi iz činjenice da je vrlo eksplozivno.
Rukovanje samostalnim slojevima
Na zlato i njegov oksid, neki spojevi, kao što su dialkil disulfidi, RSSR, nisu adsorbirani na isti način. Kada dođe do ove adsorpcije, spontano se formira Au-S veza, gdje atom sumpora pokazuje i definira kemijske karakteristike navedene površine, ovisno o funkcionalnoj skupini na koju je vezan..
RSSR se ne može adsorbirati na Au2O3, ali na metalnom zlatu. Stoga, ako se površina zlata i njegov stupanj oksidacije modificiraju, kao i veličina čestica ili slojeva Au2O3, može se oblikovati više heterogena površina.
Ova površina Au2O3-AuSR komunicira s metalnim oksidima određenih elektroničkih uređaja i tako razvija buduće pametnije površine.
reference
- Wikipedia. (2018.). Gold (III) oksid. Preuzeto s: en.wikipedia.org
- Kemijska formulacija (2018.). Zlatni oksid (III). Oporavio se od: formulaacionquimica.com
- D. Michaud. (24. listopada 2016.) Zlatni oksidi. 911 Metalurg. Preuzeto s: 911metallurgist.com
- Shi, R. Asahi i C. Stampfl. (2007). Svojstva zlatnih oksida Au2O3 i Au2O: Istraga o prvim načelima. Američko fizičko društvo.
- Cook, Kevin M. (2013). Zlatni oksid kao sloj maskiranja za regioselektivnu površinsku kemiju. Teze i disertacije. Papir 1460.


